Вычислите массу абрикосовой эссенции (сложный эфир масляной кислоты и этанола), если в реакцию вступило 142г 65% раствора масляной кислоты. Выход эссенции составляет 65% от теоретически возможного.
Ответы на вопрос:
дано
m(рраCH3CH2CH2COOH) = 142 г
W(CH3CH2CH2COOH) = 65%
η(CH3CH2CH2COOC2H5) = 65%
------------------------------------------
m пр (CH3CH2CH2COOC2H5) - ?
m(CH3CH2CH2COOH) = 142 * 65% / 100% = 92.3 g
CH3CH2CH2COOH+C2H5OH-->CH3CH2CH2COOC2H5+H2O
M(CH3CH2CH2COOH) = 88 g/mol
n(CH3CH2CH2COOH) = m/M = 92.3 / 88 = 1.05 mol
n(CH3CH2CH2COOH) = n(CH3CH2CH2COOC2H5) = 1.05 mol
M(CH3CH2CH2COOC2H5) = 116 g/mol
m теор (CH3CH2CH2COOC2H5) = n*M = n*M = 1.05*116 = 121.8 g
mпр.(CH3CH2CH2COOC2H5) = 121.8 *65% / 100% = 79.17 g
ответ 79.17 г
Объяснение:
Объяснение:
Вычислите массу абрикосовой эссенции (сложный эфир масляной кислоты и этанола), если в реакцию вступило 142г 65% раствора масляной кислоты. Выход эссенции составляет 65% от теоретически возможного.
1,05 моль 1,05 моль 1,05 моль
СН3-CH2-CH2-COOH + C2H5OH ------>C3H7COOC2H5 + H2O
Вычислим массу масляной кислоты:
m(C3H7COOH) = 142 г × 0,65 = 92,3 г
Молярная масса масляной кислоты 88 г/моль и 92,3 г масляной кислоты составляют 1,05 моль
Молярная масса сложного эфира этилбутирата равна 114 г/мол
Тогда теоретически можно получить 120 г абрикосовой эссенции, а при 65 % выходе 77,8 г этилбутирата
Дано:
V(воздуха) = 30 л = 0,03 м³
t = 28°C
p = 110 кПа = 1,1×10⁵ Па
Найти:
N - ?
1) Для начала мы запишем формулу связывающая значение давления газа с его температурой и концентрацией молекул на единицу объема, именно по такой формуле мы будем пользоваться:
p = nkT - давления газа с его температурой и концентрацией молекул на единицу объема (1)
2) Но нам не известно его концентрация молекул, но в условий известно про объем, значит мы будем пользоваться по такой формуле про концентрация молекул воздуха:
n = N/V(воздуха) - концентрация молекул воздуха (2)
3) Но нам еще не известно температуру в кельвина, но условий сказано про температуру в градусах, значит мы найдем температуру в кельвина по такой формуле:
T = (t + 273) К - температура в кельвина (3)
T = 28 + 273 = 301 К
4) Теперь складываем формулы (1) и (2), именно там ны получим формулу про нахождения числа молекул в 30 л воздуха:
p = nkT (1) n = N/V(воздуха) (2)
Следовательно:
p = N/V(воздуха) × kT | × V(воздуха)
pV(воздуха) = NkT ⇒ N = (pV(воздуха))/kT - число молекул воздуха
N = (1,1×10⁵ Па × 0,03 м³)/(1,38×10⁻²³ (Дж/К) × 301 К) = (1,1×10⁵ (Н/м²) × 0,03 м³)/(415,38×10⁻²³ Дж) = (0,033×10⁵ (Н×м))/(415,38×10⁻²³ Дж) = 3300 Дж / 415,38×10⁻²³ Дж = 3,3×10³ Дж / 415,38×10⁻²³ Дж ≈ 0,00794453×10²⁶ ≈ 7,94453×10²³
ответ: N = 7,94453×10²³
2.
Дано:
m(CaC₂) = 32 гр
Найти:
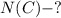
1) Для начала мы найдем количества вещества у карбид кальция, а потом у углерода содержащей из формулы карбида кальция:
M(CaC₂) = 40 + 12×2 = 40 + 24 = 64 гр/моль
n(CaC₂) = m(CaC₂)/M(CaC₂) = 32 гр / 64 гр/моль = 0,5 моль ⇒ n(C) = 2n(CaC₂) = 2×0,5 моль = 1 моль
2) Теперь находим число атомов углерода по такой формуле:
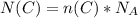 = 1 моль × 6,02×10²³ атомов = 6,02×10²³ атомов
= 1 моль × 6,02×10²³ атомов = 6,02×10²³ атомов
ответ: N(C) = 6,02×10²³ атомов
Решено от : 
Реши свою проблему, спроси otvet5GPT
-
Быстро
Мгновенный ответ на твой вопрос -
Точно
Бот обладает знаниями во всех сферах -
Бесплатно
Задай вопрос и получи ответ бесплатно

Популярно: Химия
-
Fe-fecl2-fecl3-fe(oh)3-fr2(so4)3-fe(oh)3-fe(oh3)3...
 solodkin197829.07.2021 12:33
solodkin197829.07.2021 12:33 -
С! запишите уравнения реакций для переходов: ca→ca(oh)2→caco3→cao→cacl2...
 Nikita4324217.05.2020 11:54
Nikita4324217.05.2020 11:54 -
Вивести формулу вуглеводню, маса якого 28 г/моль (алкену)....
 віка2005227.06.2020 19:46
віка2005227.06.2020 19:46 -
Вкаком веществе содержатся больше углеродов : znco3 или...
 onofon05.07.2021 06:32
onofon05.07.2021 06:32 -
Решить по . вещество, полученное присоединением 6.72 дм³ (н.у)...
 1804lenalb20.04.2022 09:28
1804lenalb20.04.2022 09:28 -
Соединение некоторого элемента э с кислородом имеет состав э₂о₃....
 pauline250406.03.2020 05:51
pauline250406.03.2020 05:51 -
1. написать уравнения электролитической диссоциации для следующих...
 semchik6021.08.2021 11:50
semchik6021.08.2021 11:50 -
Обчислити масову частку цукру у розчині що містить 120 г води і...
 pavlon4kp0bmeh05.06.2021 00:33
pavlon4kp0bmeh05.06.2021 00:33 -
Жидкая смесь - это 1. Мельхиор 2. Воздух 3. Молоко 4. Гранит...
 НЕГЛУПЫЙ2629.05.2021 04:55
НЕГЛУПЫЙ2629.05.2021 04:55 -
Укажите ,где о кислороде говорится как о химическом элементе, а...
 veronikak360204.06.2022 10:49
veronikak360204.06.2022 10:49

Есть вопросы?
-
Как otvet5GPT работает?
otvet5GPT использует большую языковую модель вместе с базой данных GPT для обеспечения высококачественных образовательных результатов. otvet5GPT действует как доступный академический ресурс вне класса. -
Сколько это стоит?
Проект находиться на стадии тестирования и все услуги бесплатны. -
Могу ли я использовать otvet5GPT в школе?
Конечно! Нейросеть может помочь вам делать конспекты лекций, придумывать идеи в классе и многое другое! -
В чем отличия от ChatGPT?
otvet5GPT черпает академические источники из собственной базы данных и предназначен специально для студентов. otvet5GPT также адаптируется к вашему стилю письма, предоставляя ряд образовательных инструментов, предназначенных для улучшения обучения.
