В 5000 мл раствора уксусной кислоты для полной нейтрализации добавили 100 мл массовой долей гидроксида натрия 30% (р = 1,1 г / см3). Вычислить молярность исходного раствора уксусной кислоты
Ответы на вопрос:
0.165 моль/л
Объяснение:
Пишем реакцию
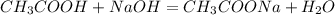
Считаем массу раствора гидроксида натрия
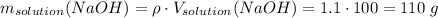
Считаем массу гидроксида натрия
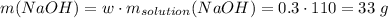
Считаем колиество вещества гидроксида натрия
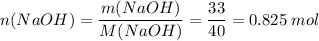
Такое же количество вещества нужно и уксусной кислоты
Считаем молярную концентрацию уксусной кислоты
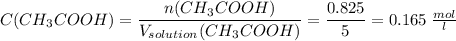
водород — самый легкий из всех газов, он в 14,5 раза легче воздуха; масса 1 л водорода при нормальных условиях равна 0,09 г. в воде водород растворим мало, но в некоторых металлах, например в никеле, палладии, платине, растворяется в значительных количествах.
с растворимостью водорода в металлах связана его способность диффундировать через металлы. кроме того, будучи самым легким газом, водород обладает наибольшей скоростью диффузии: его молекулы быстрее молекул всех других газов распространяются в среде другого вещества и проходят через разного рода перегородки. особенно велика его способность к диффузии при повышенном давлении и высоких температурах. поэтому работа с водородом в таких условиях сопряжена со значительными трудностями.
Реши свою проблему, спроси otvet5GPT
-
Быстро
Мгновенный ответ на твой вопрос -
Точно
Бот обладает знаниями во всех сферах -
Бесплатно
Задай вопрос и получи ответ бесплатно

Популярно: Химия
-
1)из переведённые ниже формул вещества выпишите формулы соединений и укажите, за...
 2002КетринПирс200227.01.2022 01:09
2002КетринПирс200227.01.2022 01:09 -
Составьте уравнения реакций в соответствии со схемой: t hcl hcl+o2 t no2...
 aguscov14.08.2022 09:36
aguscov14.08.2022 09:36 -
Какие из пигментов, добавляемых в краски, относятся к ? 1-цинковые белила 2-титановые...
 Helpmeplease111405.03.2020 11:41
Helpmeplease111405.03.2020 11:41 -
Какая разница между калиевой и кальцевой селитры?...
 MariaRosengard19.03.2022 07:51
MariaRosengard19.03.2022 07:51 -
Допишите уравнения. каждое уравнение оформите как окислительно-восстановительную...
 polsedegova17.08.2021 02:59
polsedegova17.08.2021 02:59 -
7. сравнение свойств атомов и простых веществ, образованных соседними по периоду...
 olya35520.09.2022 09:00
olya35520.09.2022 09:00 -
Втонне морской воды содержится около 50 миллиардов атомов золота. приняв, что 30...
 Лілія21012.05.2020 21:35
Лілія21012.05.2020 21:35 -
Врастворе объёмом 500 мл содержится хлорид магния массой 9,5 грамм. определить молярную...
 22557214.01.2023 13:02
22557214.01.2023 13:02 -
Объёмная доля хлора в смеси газов 15%. в каком объёме смеси содержится 18 л. хлора....
 илья194710.07.2022 01:39
илья194710.07.2022 01:39 -
Мнау арыптердын тотыгу дарежесы керек...
 wexly27.07.2020 18:48
wexly27.07.2020 18:48

Есть вопросы?
-
Как otvet5GPT работает?
otvet5GPT использует большую языковую модель вместе с базой данных GPT для обеспечения высококачественных образовательных результатов. otvet5GPT действует как доступный академический ресурс вне класса. -
Сколько это стоит?
Проект находиться на стадии тестирования и все услуги бесплатны. -
Могу ли я использовать otvet5GPT в школе?
Конечно! Нейросеть может помочь вам делать конспекты лекций, придумывать идеи в классе и многое другое! -
В чем отличия от ChatGPT?
otvet5GPT черпает академические источники из собственной базы данных и предназначен специально для студентов. otvet5GPT также адаптируется к вашему стилю письма, предоставляя ряд образовательных инструментов, предназначенных для улучшения обучения.
