Сколько мл 0,1М раствора Na2C2O4 необходимо добавить к 500мл насыщенного водного раствора CaC2O4, чтобы растворимость этой соли
составила 0,1мг/л? Изменением объема раствора пренебречь.
(ответ: V(Na2C2O4) = 14,72 мл). ответ может не совпадать
272
277
Ответы на вопрос:
14.716 мл
Объяснение:
Переведем растворимость соли в конечном растворе в моль/л
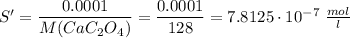
Из таблицы произведение растворимости оксалата кальция в воде равно 2.3 · 10⁻⁹
Пусть в раствор добавили Х моль оксалат-ионов в составе оксалата натрия. Тогда имеем следующее
![K_{sp}(CaC_2O_4) = [Ca^{2+}][C_2O_4^{2-}] = S' \cdot (S' + X)\\2.3\cdot10^{-9} = 7.8125\cdot10^{-7} \cdot (7.8125\cdot10^{-7} + X)\\X = 0.0029432\;mol](/tpl/images/3767/9238/7360d.png)
Считаем объем раствора оксалата натрия
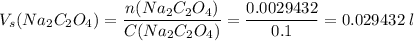
Но, мы до этого момента вели все расчеты на 1 л раствора оксалата кальция, а по условию есть только 500 мл, поэтому раствора оксалата натрия тоже надо вдвое меньше, т.е.
0.029432 / 2 = 0.014716 л или 14.716 мл
Реши свою проблему, спроси otvet5GPT
-
Быстро
Мгновенный ответ на твой вопрос -
Точно
Бот обладает знаниями во всех сферах -
Бесплатно
Задай вопрос и получи ответ бесплатно

Популярно: Химия
-
Вычислите массу железа, которую можно получить с 4 кг железа (iii)...
 яна275417.01.2021 07:53
яна275417.01.2021 07:53 -
Расставьте коэффициенты в схемах и определите, к какому типу относится...
 MrRazor109.07.2022 13:56
MrRazor109.07.2022 13:56 -
Биополимеры на примере серина и треонина. решите , уже всю голову...
 DiaPika25.08.2022 10:34
DiaPika25.08.2022 10:34 -
Укажите из соединений дигидрофосфат трехвалентного металла, а)...
 NoName464308.09.2021 22:00
NoName464308.09.2021 22:00 -
При взаимодействии 22 г раствора хлори, а кальция с 2 г нитрата...
 Такблэт22825.04.2021 07:00
Такблэт22825.04.2021 07:00 -
Относительная атомная масса натрия равна...
 ModerBlet21.02.2022 09:37
ModerBlet21.02.2022 09:37 -
Обьем оксида углерода, полученном при полном сгорании 810 г крахмала,...
 liona67601.11.2021 21:22
liona67601.11.2021 21:22 -
Закончите уравнения реакции обмена и укажите причину протекания...
 Лера981402.04.2023 05:41
Лера981402.04.2023 05:41 -
Вряду hcl - hbr - hi при растворении в воде:...
 Psix7310.01.2020 06:40
Psix7310.01.2020 06:40 -
Один из способов получения кальциевой селитры состоит в нейтрализации...
 AlumaZuma16.06.2022 09:45
AlumaZuma16.06.2022 09:45

Есть вопросы?
-
Как otvet5GPT работает?
otvet5GPT использует большую языковую модель вместе с базой данных GPT для обеспечения высококачественных образовательных результатов. otvet5GPT действует как доступный академический ресурс вне класса. -
Сколько это стоит?
Проект находиться на стадии тестирования и все услуги бесплатны. -
Могу ли я использовать otvet5GPT в школе?
Конечно! Нейросеть может помочь вам делать конспекты лекций, придумывать идеи в классе и многое другое! -
В чем отличия от ChatGPT?
otvet5GPT черпает академические источники из собственной базы данных и предназначен специально для студентов. otvet5GPT также адаптируется к вашему стилю письма, предоставляя ряд образовательных инструментов, предназначенных для улучшения обучения.
