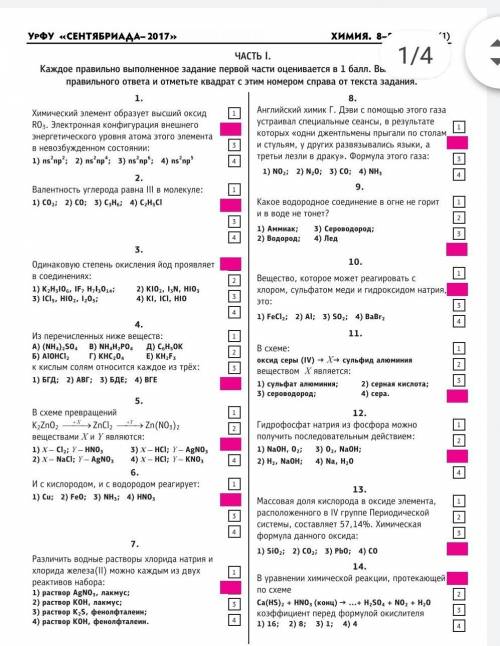
ответьте на 2 ответа по химии Какое из веществ не реагирует с соляной кислотой?
1) SO3 2) Na2CO3 3) CaO 4) NaOH
Какую массу воды надо взять, чтобы приготовить 85 г 20%-ного раствора соли?
1) 80 г 2) 49 г 3) 65 г 4) 68
Ответы на вопрос:
1. Какое из веществ не реагирует с соляной кислотой?
Соляная кислота (HCl) реагирует с Na₂CO₃, CaO, NaOH
1) 2HCl + Na₂CO₃ → 2NaCl + H₂O + CO₂↑
2) 2HCl + CaO → CaCl₂ + H₂O
3) HCl + NaOH = NaCl + H₂O
Соляная кислота (HCl) не реагирует с SO₃, потому что кислота не может взаимодействовать с кислотными оксидами. Кислота может взаимодействовать только с металлом, основным оксидом, основанием, солью!
ответ: 1) SO₃
2. Какую массу воды надо взять, чтобы приготовить 85 г 20%-ного раствора соли?
----------------------------------------------------------------------------------------
Дано:
m(р-ра соли) = 85 гр
ω(соли) = 20%
---------------------------
Найти:
m(H₂O) - ?
m(соли) = m(р-ра соли)×ω(соли)/100% = 85 гр × 20% / 100% = 17 гр
m(H2O) = m(р-ра соли) - m(соли) = 85 гр - 17 гр = 68 гр
ответ: m(H₂O) = 68 гр
Реши свою проблему, спроси otvet5GPT
-
Быстро
Мгновенный ответ на твой вопрос -
Точно
Бот обладает знаниями во всех сферах -
Бесплатно
Задай вопрос и получи ответ бесплатно

Популярно: Химия
-
Вкаком оксиде щелочных элементов массовая доля оксигена наибольшая...
 kajaiuw18.04.2021 07:17
kajaiuw18.04.2021 07:17 -
Реакции с электронным li+p cro_{3} +ca zn+o_{2} na+n_{2}...
 bangorucc15.12.2021 21:41
bangorucc15.12.2021 21:41 -
S → SO2 →Cs2SO3 → H2SO3 → SO2 → SO3...
 MiYaG1130.08.2020 00:26
MiYaG1130.08.2020 00:26 -
Установите соответствие между названием вещества и классом органических...
 krllzrbn44229.06.2023 23:51
krllzrbn44229.06.2023 23:51 -
К 650 граммам 19%-ного раствора ортофосфорной кислоты добавили 200 граммов...
 qwertyuiopasdfjdkdhx07.02.2022 20:07
qwertyuiopasdfjdkdhx07.02.2022 20:07 -
Аос состовляет 111° . Внутри этого угла проведён луч ОА . Сколько градусов...
 sashka158622.01.2021 17:27
sashka158622.01.2021 17:27 -
Оксид серы (vi) взаимодействует с каждым из двух веществ...
 Оля02513.11.2020 07:51
Оля02513.11.2020 07:51 -
На лужний метал масою 7.8г подіяли надлишком води утворився гідроксид...
 nalininegi05.01.2021 01:58
nalininegi05.01.2021 01:58 -
При сжатии метана образовалось 84л оксида углерода 4, какая масса углерода...
 rayl228.07.2020 06:21
rayl228.07.2020 06:21 -
Рассчитайте относительные молекулярные массы соединений: (a) CO2 ...
 Vostafi25.06.2023 08:01
Vostafi25.06.2023 08:01

Есть вопросы?
-
Как otvet5GPT работает?
otvet5GPT использует большую языковую модель вместе с базой данных GPT для обеспечения высококачественных образовательных результатов. otvet5GPT действует как доступный академический ресурс вне класса. -
Сколько это стоит?
Проект находиться на стадии тестирования и все услуги бесплатны. -
Могу ли я использовать otvet5GPT в школе?
Конечно! Нейросеть может помочь вам делать конспекты лекций, придумывать идеи в классе и многое другое! -
В чем отличия от ChatGPT?
otvet5GPT черпает академические источники из собственной базы данных и предназначен специально для студентов. otvet5GPT также адаптируется к вашему стилю письма, предоставляя ряд образовательных инструментов, предназначенных для улучшения обучения.