1) Определите вид химической связи в веществах: K, KCl, Cl2, CCl4
2) Из перечня веществ выберите формулы солей и назовите их: ZnSO4, Fe(NO3)3, NH3, Cu(OH)2, P2O5, Fe(OH)2, OF2, H3PO4, Na2SO₃, HCl, H2O
3)Используя метод электронного баланса, составьте уравнение реакции, соответствующее схеме превращения. Определите окислитель и восстановитель Cu(NO3)2 + Al → Al(NO₃)₃ + Cu
4)
Задача: Какая масса осадка образуется при взаимодействии 16 гр. соляной кислоты с нитратом серебра? Укажите тип реакции и признак протекания реакции через 20 минут контрольная!!!
250
458
Ответы на вопрос:
1) K - металлическая связь. KCl - ионная связь. Cl2 - ковалентная неполярная. CCl4 - ковалентная полярная.
2) ZnSO4 - сульфат цинка. Fe(NO3)3 - нитрат железа 3. Na2SO3 - сульфИТ натрия
3) Cu - окислитель. Получает два электрона. Al- восстановитель, отдаёт три электрона.
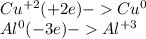 Общее уравнение : 3Сu(NO3)2 +2Al = 2Al(NO3)3 + 3Cu
Общее уравнение : 3Сu(NO3)2 +2Al = 2Al(NO3)3 + 3Cu
4) HCl + AgNO3 -> AgCl (осадок белого цвета) + HNO3
n(HCl) = 16/36.5=0,44
n(HCl) = n(AgCl) => m(AgCl) = 0,44*143,5=63,14 г
Реакция ионного обмена. Признак протекания реакции - осадок белого цвета AgCL
Объяснение:
Щелочью тогда в конченой реакции выделится аммиак ,который имеет характерный запах. можно ещё соляной кислотой,тогда в ходе реакции выделится белый дым + ещё выделится углекислый газ. но лучше всего проверять щёлочью например : карбонат аммония + гидроксид бария - выделится аммиак и белый осадок
Реши свою проблему, спроси otvet5GPT
-
Быстро
Мгновенный ответ на твой вопрос -
Точно
Бот обладает знаниями во всех сферах -
Бесплатно
Задай вопрос и получи ответ бесплатно

Популярно: Химия
-
Какую массу воды надо добавить к 10 г 80%-ной уксусной эссенции для получения 3%-го...
 ЯхочуВхогвартс22.03.2020 22:07
ЯхочуВхогвартс22.03.2020 22:07 -
Составить реакцию хлорид фенил аммония-вода...
 alinkamarkova8217.06.2023 16:48
alinkamarkova8217.06.2023 16:48 -
По предложенной схеме составтье уравнения реакций : a) h2co3 б) h2so4 в) h3bo3 г)...
 165200108.01.2021 08:47
165200108.01.2021 08:47 -
Во время сжигания пропана объёмом 56 л.(н.у) образуется карбон (iv) оксид количеством...
 назым2431.07.2021 23:55
назым2431.07.2021 23:55 -
1)реакция получения полиэтилена 2)реакция получения полистирола...
 missrayn132417.08.2022 05:21
missrayn132417.08.2022 05:21 -
Водород вытесняется из кислот металлом: а) hg б) ag в) al г) cu...
 kasatka055609.06.2021 12:26
kasatka055609.06.2021 12:26 -
Составить уравнение реакции: сac2- c2h2- c6h6- c6h5no2- c6h5nh2- c6h5nh3cl- h2o...
 LilGirl121.01.2023 13:50
LilGirl121.01.2023 13:50 -
Назовите самые распространенные металлы...
 enderrock8411.09.2022 16:56
enderrock8411.09.2022 16:56 -
Вычислить массовую долю фосфора в fe po4...
 artur1749922.02.2021 05:28
artur1749922.02.2021 05:28 -
Аммиак, объемом 5,6 л (н. пропустили через 100г 24,5%-ного раствора серной кислоты....
 ТёмаТащер29.11.2022 14:25
ТёмаТащер29.11.2022 14:25

Есть вопросы?
-
Как otvet5GPT работает?
otvet5GPT использует большую языковую модель вместе с базой данных GPT для обеспечения высококачественных образовательных результатов. otvet5GPT действует как доступный академический ресурс вне класса. -
Сколько это стоит?
Проект находиться на стадии тестирования и все услуги бесплатны. -
Могу ли я использовать otvet5GPT в школе?
Конечно! Нейросеть может помочь вам делать конспекты лекций, придумывать идеи в классе и многое другое! -
В чем отличия от ChatGPT?
otvet5GPT черпает академические источники из собственной базы данных и предназначен специально для студентов. otvet5GPT также адаптируется к вашему стилю письма, предоставляя ряд образовательных инструментов, предназначенных для улучшения обучения.
