Смесь железа и оскида железа (II) обработали избытком соляной кислоты. Определите массу оскида в исходной смеси, если в ходе реакции образовалось 127г соли и выделилось 13,44л газа при (н.у)
Ответы на вопрос:
Дано:
Fe + FeO
HCl
m(FeCl2)=127 г
V(H2) = 13,44 л
Найти: m(FeO)-?
Запишем 2 уравнения и подпишем объем водорода в первой реакции, так как он образуется только в одной реакции
х г 13,44 л
1) Fe + 2HCl = FeCl2 + H2↑
127 г 22,4 л
(127-х)г
2) FeO + 2HCl = FeCl2 + H2O
Пусть, масса FeCl2 в первой реакции равна х г. Тогда, масса FeCl2 во второй реакции равна (127 - х) г. Подпишем это
Найдем массу FeCl2 в первой реакции
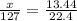
m1(FeCl2) = 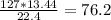 г
г
Если масса FeCl2 в первой реакции 76.2 г , то масса FeCl2 во второй реакции = 127 - 76,2 = 50,8 г
Перепишем еще раз вторую реакцию и подпишем массу FeCl2
у г 50,8 г
FeO + 2HCl = FeCl2 + H2O
72 г 127 г
Найдем массу оксида железа(II)
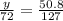
m(FeO) = 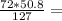 28.8 г
28.8 г
ответ: m(FeO)=28.8 г
дано:
m(s)=100г.
m(so₂
решение:
1. определим молярную массу серы:
m(s)=32г./моль
2. определим количество вещества серы массой 100г.:
n₁(s)=m(s)÷m(s)
n₁(s)=100г.÷32г./моль=3,1моль
3. запишем уравнение реакции:
s+o₂=so₂
по уравнению реакции:
n(s)=n(so₂)=1моль
по условию :
n₁(s)=n₁(so₂)=3,1моль
4. определим массу оксида серы(iv) количеством 3,1моль:
m(so₂)=n₁(so₂)xm(s)
m(so₂)=3,1мольх32г./моль=99,2г.
5. ответ: при взаимодействии 100 грамм серы с кислородом образвался оксид серы(iv) массой 99,2г.
Реши свою проблему, спроси otvet5GPT
-
Быстро
Мгновенный ответ на твой вопрос -
Точно
Бот обладает знаниями во всех сферах -
Бесплатно
Задай вопрос и получи ответ бесплатно

Популярно: Химия
-
Гидроксид меди в реакция cu(oh) 2+2hcl=cucl2+h2o...
 Artemka1337w17.08.2020 01:15
Artemka1337w17.08.2020 01:15 -
Составьте молекулярные и ионные уравнения следующих реакций: а) сульфатом...
 976Марина111111111131.10.2022 11:07
976Марина111111111131.10.2022 11:07 -
Расставьте коэффициенты в окислительно-восстановительной реакции методом...
 qwertyyyyyyy12508.01.2021 09:05
qwertyyyyyyy12508.01.2021 09:05 -
Этилен + hbr - x - y+na - хлорбутан...
 к2а2т2я06.06.2023 12:16
к2а2т2я06.06.2023 12:16 -
Комиртек атомынын электрондык формуласы...
 ayratka210.07.2021 23:30
ayratka210.07.2021 23:30 -
Feo+co=fe+co2 разобрать в окислительно восстановительном точки зрения...
 саша400520.04.2022 17:45
саша400520.04.2022 17:45 -
Сколько литров бутана сгорело если в результате образовалось 175л...
 улгкармцрваейьоц12.03.2021 04:38
улгкармцрваейьоц12.03.2021 04:38 -
Определить окислитель-восстановитель feo+o2=fe2o3...
 zroslama13.12.2021 15:51
zroslama13.12.2021 15:51 -
.(Обчислить объем углекислого газа (н. у), который выделяется в результате...
 artem5545229.04.2021 05:06
artem5545229.04.2021 05:06 -
До какого объема следует разбавить 500мл 20%-ного раствора хлорида...
 stovolosova0325.05.2021 17:20
stovolosova0325.05.2021 17:20

Есть вопросы?
-
Как otvet5GPT работает?
otvet5GPT использует большую языковую модель вместе с базой данных GPT для обеспечения высококачественных образовательных результатов. otvet5GPT действует как доступный академический ресурс вне класса. -
Сколько это стоит?
Проект находиться на стадии тестирования и все услуги бесплатны. -
Могу ли я использовать otvet5GPT в школе?
Конечно! Нейросеть может помочь вам делать конспекты лекций, придумывать идеи в классе и многое другое! -
В чем отличия от ChatGPT?
otvet5GPT черпает академические источники из собственной базы данных и предназначен специально для студентов. otvet5GPT также адаптируется к вашему стилю письма, предоставляя ряд образовательных инструментов, предназначенных для улучшения обучения.
