Распределение электронов по энергетическим уровням железа соответствует числам...
1. 2е8е18е2е
2. 2е8е8е8е
3. 2е8е14е2е
4. 2е8е13е3е
2. От других металлов железо отличается свойством
1. электропроводность
2. серебристо- белый цвет
3. магнетизм
4. теплопроводность
3. Железо в окислительно-восстановительных реакциях является:
1. только восстановителем
2. только окислителем
3. проявляет двойственность окислитедьно-восстановительных свойств
4. не проявляет окислительно-восстановительных свойств
4. Железо реагирует с каждым из веществ в паре
1. CuSO4, KOH
2. O2, Al2O3
3. S, Pb(NO3)2
4. HCl, He
5. Железо не реагирует, т.к. его пассивирует:
1. холодная концентрированная соляная кислота
2. холодная концентрированная серная кислота
3. горячая разбавленная серная кислота
4. горячая разбавленная соляная кислота
6. Оксид железа (II) может быть получен в результате:
1. взаимодействия железа с водой
2. окисления железа кислородом
3. разложения Fe(OH)3
4. разложения Fe(OH)2
7. Оксид железа (III) проявляет:
1. амфотерные свойства
2. кислотные свойства
3. основные свойства
4. не проявляет свойств
8. Хлорид железа (III) и хлорид железа (II) соответственно могут быть получены в результате взаимодействия железа с...
1. хлором и соляной кислотой
2. хлоридом алюминия и хлором
3. соляной кислотой и хлоридом магния
4. соляной кислотой и хлором
9. Гидроксид железа (II) может быть получен в результате взаимодействия:
1. FeCl3 + КОН
2. FeO + Н2O
3. FeCl2 + КОН
4. Fe + Н2О
10. Качественными реакциями на ион железа Fe3+ является взаимодействие с...
1. сульфатом бария
2. серной кислотой
3. нитратом серебра
4. роданидом калия
11. Fe(OH)3 взаимодействует с веществами ряда:
1. HCl, Na, СО2
2. HCl, NaOH, HNO3
3. СО2, Cl2, HCl
4. NaOH, HNO3, CuSO4
12. Гидроксид железа (III) может быть получен в результате взаимодействия:
1. Fe(OH)2 + Н2O + O2
2. Fe2O3 + Н2О
3. FeS + КОН
4. Fe + NaOH
13. Гидроксид железа (II) взаимодействует с веществами ряда:
1. HCl, Na2CO3, NaOH
2. HCl, H2О, КОН
3. HCl, О2 + H2О, HNO3
4. NaOH, Н3РO4 , Na2SO4
14. Гидроксиды железа (II) и (III) можно отличить с Найдите соответствие между исходными реагентами и продуктами.
1) Fe + Cl2 .
2) Fe + O2 .
3) Fe + HCl (разб.) .
4) Fe + H2O (пар) . б) FeCl2 + H2.
в) Fe3O4 + H2.
д) FeCl3.
е) Fe3O4.
ж) FeCl3 + H2.
Ответы на вопрос:
Объяснение: Во многих случаях правильные ответы дополнительно выделены полужирным шрифтом
1. Распределение электронов по энергетическим уровням железа соответствует числам... 3. 2е8е14е2е
1. 2е8е18е2е
2. 2е8е8е8е
3. 2е8е14е2е
4. 2е8е13е3е
2. От других металлов железо отличается свойством 3. магнетизм
1. электропроводность
2. серебристо- белый цвет
3. магнетизм
4. теплопроводность
3. Железо в окислительно-восстановительных реакциях является:
1. только восстановителем
2. только окислителем
3. проявляет двойственность окислитедьно-восстановительных свойств
4. не проявляет окислительно-восстановительных свойств
4. Железо реагирует с каждым из веществ в паре
1. CuSO4, KOH
2. O2, Al2O3
3. S, Pb(NO3)2
4. HCl, He
5. Железо не реагирует, т.к. его пассивирует: 2. холодная концентрированная серная кислота
1. холодная концентрированная соляная кислота
2. холодная концентрированная серная кислота
3. горячая разбавленная серная кислота
4. горячая разбавленная соляная кислота
6. Оксид железа (II) может быть получен в результате: 4. разложения Fe(OH)2
1. взаимодействия железа с водой
2. окисления железа кислородом
3. разложения Fe(OH)3
4. разложения Fe(OH)2
7. Оксид железа (III) проявляет: 1. амфотерные свойства
1. амфотерные свойства
2. кислотные свойства
3. основные свойства
4. не проявляет свойств
8. Хлорид железа (III) и хлорид железа (II) соответственно могут быть получены в результате взаимодействия железа с... 1. хлором и соляной кислотой
1. хлором и соляной кислотой
2. хлоридом алюминия и хлором
3. соляной кислотой и хлоридом магния
4. соляной кислотой и хлором
9. Гидроксид железа (II) может быть получен в результате взаимодействия: 3. FeCl2 + КОН
1. FeCl3 + КОН
2. FeO + Н2O
3. FeCl2 + КОН
4. Fe + Н2О
10. Качественными реакциями на ион железа Fe3+ является взаимодействие с... 4. роданидом калия
1. сульфатом бария
2. серной кислотой
3. нитратом серебра
4. роданидом калия
11. Fe(OH)3 взаимодействует с веществами ряда: 2. HCl, NaOH, HNO3
1. HCl, Na, СО2
2. HCl, NaOH, HNO3
3. СО2, Cl2, HCl
4. NaOH, HNO3, CuSO4
12. Гидроксид железа (III) может быть получен в результате взаимодействия: 1. Fe(OH)2 + Н2O + O2
1. Fe(OH)2 + Н2O + O2
2. Fe2O3 + Н2О
3. FeS + КОН
4. Fe + NaOH
13. Гидроксид железа (II) взаимодействует с веществами ряда: 3. HCl, О2 + H2О, HNO3
1. HCl, Na2CO3, NaOH
2. HCl, H2О, КОН
3. HCl, О2 + H2О, HNO3
4. NaOH, Н3РO4 , Na2SO4
14. Гидроксиды железа (II) и (III) можно отличить с Найдите соответствие между исходными реагентами и продуктами.
1) Fe + Cl2 д) FeCl3.
2) Fe + O2 е) Fe3O4.
3) Fe + HCl (разб.) . б) FeCl2 + H2.
4) Fe + H2O (пар) в) Fe3O4 + H2.
в) Fe3O4 + H2.
д) FeCl3.
е) Fe3O4.
ж) FeCl3 + H2.
Объяснение:
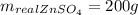
Объяснение:
Начнем решение с составления уравнения, нам не известно какая по концентрации кислота, однако это и не имеет значения ибо во всех уравнениях коэффициенты перед цинком и сульфатом цинка одинаковы для разбавленной (1) и концентрированных (2, 3) кислот
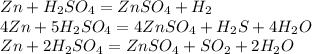
Поэтому возьмём с разбавленной (1):
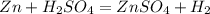
Итак посчитаем количество чистого цинка в смеси, так как примесей 10%, то чистого вещества 90%:
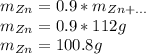
Найдем количество вещества цинка, для этого массу разделим на молярную массу:
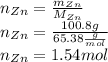
Количество сульфата цинка равно количеству цинка, так как коэффициенты в реакции равны 1 и 1 соответственно, значит теоретическое количество сульфата цинка тоже равно 1.54 моль
Найдем теоретическую массу сульфата цинка, для этого количество вещества умножим на молярную массу:
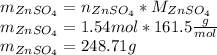
Найдем практическую массу, для этого теоретическую массу умножим на выход реакции:
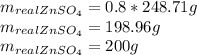
Реши свою проблему, спроси otvet5GPT
-
Быстро
Мгновенный ответ на твой вопрос -
Точно
Бот обладает знаниями во всех сферах -
Бесплатно
Задай вопрос и получи ответ бесплатно

Популярно: Химия
-
Укакого из оксидов азота более выражены кислотные свойства.? 1) n2o.2)no...
 koshulinskayag14.06.2022 05:37
koshulinskayag14.06.2022 05:37 -
Теория строения органических веществ бутлерова, основные положения (кратко)...
 vladuha69105.03.2020 21:15
vladuha69105.03.2020 21:15 -
Сколько необходимо взять железного купороса чтобы приготовить 500г 7%ого...
 Molina123405.01.2020 06:52
Molina123405.01.2020 06:52 -
Написать структурные формулы 5-пропил-3,4,5-триметилгептан и 3,4-диметил-2,3,5-трибромгексан...
 arti5201.01.2020 18:52
arti5201.01.2020 18:52 -
Сколько литров газа выделится если растворить mgco3 массой 168 г в избытке...
 050876168124.03.2023 17:24
050876168124.03.2023 17:24 -
Ионы br образуются при диссоциации вещества 1)albr3 2)al 3)alcl3 4)h2...
 NetBPeMeHu30.12.2021 10:54
NetBPeMeHu30.12.2021 10:54 -
Нужна по физике 10 класс...
 lilytrap04.07.2022 07:53
lilytrap04.07.2022 07:53 -
Даны 2 раствора паворной соли.Одинс массой долей 25%,а другой 45%.вычисли...
 r297354828.03.2020 08:43
r297354828.03.2020 08:43 -
CH3-CH3(CH3)-CH2-CH3+HO-NO2- t. конц Н2SO4...
 Artem346019.03.2023 22:56
Artem346019.03.2023 22:56 -
Составить молекулярные и ионные уравнения CaCl2 + K2CO3 = H2SO4 + LiOH...
 stefaniya200805.03.2023 07:53
stefaniya200805.03.2023 07:53

Есть вопросы?
-
Как otvet5GPT работает?
otvet5GPT использует большую языковую модель вместе с базой данных GPT для обеспечения высококачественных образовательных результатов. otvet5GPT действует как доступный академический ресурс вне класса. -
Сколько это стоит?
Проект находиться на стадии тестирования и все услуги бесплатны. -
Могу ли я использовать otvet5GPT в школе?
Конечно! Нейросеть может помочь вам делать конспекты лекций, придумывать идеи в классе и многое другое! -
В чем отличия от ChatGPT?
otvet5GPT черпает академические источники из собственной базы данных и предназначен специально для студентов. otvet5GPT также адаптируется к вашему стилю письма, предоставляя ряд образовательных инструментов, предназначенных для улучшения обучения.
