Часть А. Тестовые задания с выбором одного правильного ответа.
А1. Формула двухосновной бескислородной кислоты
1)H2S 2) HCl 3) HNO3 4) H3PO4
А2. Кислота – слабый электролит
1)азотная 2) соляная 3) серная 4) сернистая
А3.Кислота, анион которой имеет заряд «2 – »
1)азотистая 2) угольная 3) фосфорная 4) соляная
А4.Ряд формул в котором все вещества – кислоты
1)HCl, H3PO4, H2SO4 3) HI, P2O5, H3PO4
2) NaOH, H2S, H2CO34) HNO2, КCl, HF
А5. Вещество, с которым взаимодействует раствор серной кислоты
1)ртуть 2) оксид кремния 3) оксид железа (II)4) кремниевая кислота
А6. Ионы, которые не могут присутствовать в растворе одновременно
1)Ba2+иOH- 2) H+иNO3- 3) Ag+иCl- 4) Na+иSO42-
А7.Формула вещества Х в уравнении реакции Х +H2SO4 = MgSO4 + H2↑
1)Mg 2) MgO 3) MgSO4 4) Mg(OH)2
Часть В.Тестовые задания с выбором двух правильных ответов (В1) и на соотнесение (В2)
В1. Вещества, с которыми взаимодействует соляная кислота
1)нитрат серебра 2) оксид серы (IV)3) бромид калия
4) цинк 5) медь
В2. Установите соответствие между формулой кислоты и формулой соответствующего ей оксида
Формула кислоты Формула оксида
А) HNO31) SO2
Б) H2SO3 2) N2O3
В) HNO2 3) N2O5
4) NO
5) SO3
245
335
Ответы на вопрос:
Привіт! Зараз ми швидко усе запишемо:
Дано: m(H₂O)=75 г , m(KNO₃)=25 г, m(розчину)=m(H₂O)+m(KNO₃)=75+25=100 г
I. Запишемо рівняння реакції: KNO₃ + H₂O = KNO₃ · H₂O (розчин)
II. Запишемо формули // Виконаємо обчислення :
w(E)=m(E)/m(розчину) · 100%
w(KNO₃)= 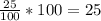
Відповідь: 25%
Готово! Є питання? Запитуйте, з радістю відповім
Реши свою проблему, спроси otvet5GPT
-
Быстро
Мгновенный ответ на твой вопрос -
Точно
Бот обладает знаниями во всех сферах -
Бесплатно
Задай вопрос и получи ответ бесплатно

Популярно: Химия
-
Опишіт фізичні властивості крейди! опишите свойства мела! 25...
 gerakostya21.06.2022 06:33
gerakostya21.06.2022 06:33 -
Простое найдите в интернете формулы веществ : сахар, уксусная...
 HappyPerson2317.01.2020 01:58
HappyPerson2317.01.2020 01:58 -
Какой из гидроксидов щелочных металлов является самым сильным...
 Celestialess3220.11.2020 23:11
Celestialess3220.11.2020 23:11 -
Много )) определите окислительно - восстановительные реакции....
 оченьнужно22830026.08.2021 11:12
оченьнужно22830026.08.2021 11:12 -
Составьте суммарные электронные уравнения и укажите, какой процесс...
 Eva06An20.07.2021 23:25
Eva06An20.07.2021 23:25 -
Добрый день, можете мне . Смесь двух жиров общей массой 100...
 IHannahI13.06.2021 22:41
IHannahI13.06.2021 22:41 -
Здраствуйте . Смесь этилацетата и гексилацетата сожгли, масса...
 EvilHany14.11.2021 02:42
EvilHany14.11.2021 02:42 -
1. Налийте в пробірку 1-2 мл розчину мідного купоросу CuSO⁴...
 1337luntik228227.06.2023 06:30
1337luntik228227.06.2023 06:30 -
Осуществить цепочки превращений. Химия 10 класс...
 MoLLoM01.04.2021 05:51
MoLLoM01.04.2021 05:51 -
Расчитайте кол-во вещества co2, образующегося при сгорании 3...
 morvilous7714.05.2022 22:27
morvilous7714.05.2022 22:27

Есть вопросы?
-
Как otvet5GPT работает?
otvet5GPT использует большую языковую модель вместе с базой данных GPT для обеспечения высококачественных образовательных результатов. otvet5GPT действует как доступный академический ресурс вне класса. -
Сколько это стоит?
Проект находиться на стадии тестирования и все услуги бесплатны. -
Могу ли я использовать otvet5GPT в школе?
Конечно! Нейросеть может помочь вам делать конспекты лекций, придумывать идеи в классе и многое другое! -
В чем отличия от ChatGPT?
otvet5GPT черпает академические источники из собственной базы данных и предназначен специально для студентов. otvet5GPT также адаптируется к вашему стилю письма, предоставляя ряд образовательных инструментов, предназначенных для улучшения обучения.
