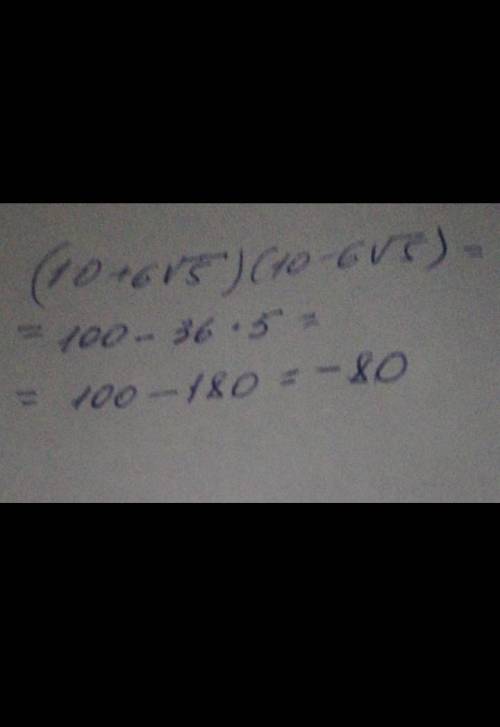Составьте уравнения реакций азотной кислоты (в молекулярном и ионном виде) с веществами:
cao, mgco3, ba(oh)2, (nh4)2co3 , al2o3.
напишите реакции разложения солей:
hg(no3)2, fe(no3)3, nano3, ba(no3)2, nh4no3, cu(no3)2
осуществите цепочки превращений:
а) (nh4)2co3 → nh3 → no → no2 → hno3→ nh4no3→ n2o
б) cu→ cu(no3)2 → no2 → hno3 → ba(no3)2 → baso4
100 !
Ответы на вопрос:
ответ:
объяснение:
1) 2hno3 + cao = ca(no3)2 + h2o
2h(+) + 2no3(-) + cao = ca(2+)+ 2no3(-) + h2o
2h(+)+ cao = ca(2+) + h2o
mgco3 +2 hno3 = mg(no3)2 + co2↑ + h2o
mgco3 + 2h(+)+ 2no3(-) = mg(2+) + 2no3(-) + co2↑ + h2o
mgco3 + 2h(+) = mg(2+) + co2↑ + h2o
ba(oh)2 + 2hno3 = ba(no3)2 + 2h2o
ba(2+) + 2oh(-) + 2h(+) +2no3(-) = ba(2+) + 2no3(-) + 2h2o
oh(-) +h(+) = h2o
(nh4)2co3 + 2hno3 = 2nh4no3 + co2↑ + h2o
2nh4(+) + co3(2-) + 2h(+) + 2no3(-) = 2nh4(+) + 2no3(-) + co2↑ + h2o
co3(2-) + 2h(+) = co2↑ + h2o
al2o3 + 6hno3 = 2al(no3)3 + 3h2o
al2o3 + 6h(+) + 6no3(-) = 2al(3+) + 6no3(-) + 3h2o
al2o3 + 6h(+) = 2al(3+) + 3h2o
2) hg(no3)2 -> hg + 2no2 + o2
4fe(no3)3 -> 2fe2o3 + 12no2 +3o2
2nano3 -> 2nano2 + o2
ba(no3)2 -> ba(no2)2 + o2
nh4no3 -> n2o + 2h2o
2cu(no3)2 -> 2cuo + 4no2 + o2
3) a) (nh4)2co3 -> 2nh3 + co2 + h2o
4nh3 + 5o2 = 4no + 6h2o
2no + o2 = 2no2
2no2 + h2o = hno3 + hno2
hno3 + nh3 =nh4no3
nh4no3=n2o + 2h2o
б) cu + 4hno3 = cu(no3)2 + 2no2↑ + 2h2o
2cu(no3)2 -> 2cuo + 4no2↑ + o2↑
2no2 + h2o = hno3 + hno2
2hno3 + bao = ba(no3)2 + h2o
ba(no3)2 + h2so4 = baso4↓ + 2hno3
Реши свою проблему, спроси otvet5GPT
-
Быстро
Мгновенный ответ на твой вопрос -
Точно
Бот обладает знаниями во всех сферах -
Бесплатно
Задай вопрос и получи ответ бесплатно

Популярно: Химия
-
Спиртовой раствор иода приготовили,смешав 10 грамм иода, 4 грамма иодида калия,...
 мирби119.05.2020 17:05
мирби119.05.2020 17:05 -
Как в нейтральных комплексах между собой связаны лиганд(являющийся нейтральной...
 Milkapilka1115.05.2022 13:15
Milkapilka1115.05.2022 13:15 -
Скільки мілілітрів води треба взяти для розчинення 27,8г залізного купоросу,щоб...
 кен12722.06.2021 08:45
кен12722.06.2021 08:45 -
Дана формула zn(hso4)2, сколько элементов содержит такая молекула? из скольких...
 ВераПончик21.06.2022 12:26
ВераПончик21.06.2022 12:26 -
При разложении перманганата калия kmno4 образуется манганат калия k2mno4 оксид...
 ffinparnisha30.06.2020 22:25
ffinparnisha30.06.2020 22:25 -
На тему чому потрібно піклуватися по власне здоровя...
 Мозг6661514.07.2020 16:08
Мозг6661514.07.2020 16:08 -
1. кормление бактерий включает в себя: а / сапрофит; б / паразитарный; v /...
 dalqwe10.07.2020 06:04
dalqwe10.07.2020 06:04 -
Об’єм h2s, виміряний при t=17 °с та тиску 98,64 кпа, становить 1,8 л. розрахуйте...
 unknown201502.02.2021 09:54
unknown201502.02.2021 09:54 -
магній оксид 3,4 г з масовою часткою домішок 5% повністю розчинили в сульфатній...
 Лина5г04.02.2022 13:25
Лина5г04.02.2022 13:25 -
Вычислить теплоту сгорания фосфора при 15,5 кг фосфора...
 Кепики22.02.2023 21:25
Кепики22.02.2023 21:25

Есть вопросы?
-
Как otvet5GPT работает?
otvet5GPT использует большую языковую модель вместе с базой данных GPT для обеспечения высококачественных образовательных результатов. otvet5GPT действует как доступный академический ресурс вне класса. -
Сколько это стоит?
Проект находиться на стадии тестирования и все услуги бесплатны. -
Могу ли я использовать otvet5GPT в школе?
Конечно! Нейросеть может помочь вам делать конспекты лекций, придумывать идеи в классе и многое другое! -
В чем отличия от ChatGPT?
otvet5GPT черпает академические источники из собственной базы данных и предназначен специально для студентов. otvet5GPT также адаптируется к вашему стилю письма, предоставляя ряд образовательных инструментов, предназначенных для улучшения обучения.