Для получения феррохрома восстановили смесь, состоящую из 200 кг оксида железа(iii) и 300 кг оксида хрома(iii). сколько требуется алюминия для восстановления и каков процентный состав полученного сплава?
Ответы на вопрос:
1) Для начала мы запишем схему гальванического элемента:
Pt | Fe⁺³(0,1 моль/л) , Fe⁺²(10⁻² моль/л) || Au⁺(10⁻² моль/л), Au⁺³(0,1 моль/л) | Pt
2) Далее мы определяем какой из них катод и анод, значит из этого гальванического элемента:
Fe - Анод Au - Катод
A⁻ : Pt | Fe⁺³(0,1 моль/л) , Fe⁺²(10⁻² моль/л) || Au⁺(10⁻² моль/л), Au⁺³(0,1 моль/л) | Pt : K⁺
3) Теперь записываем гальванические процессы у катода и анода и потом получим уравнение токообразующей реакции :
K⁺ : Fe⁺² - 1e⁻ → Fe⁺³ | 1 | | 2 | - восстановитель E₁° = -0,77 В
| | 2 | |
A⁻ : Au⁺³ + 2e⁻ → Au⁺ | 2 | | 1 | - окислитель E₂° = 1,40 В
2Fe⁺² - 2e⁻ + Au³⁺ + 2e⁻ → 2Fe⁺³ + Au⁺
2Fe⁺² + Au³⁺ → 2Fe⁺³ + Au⁺ - токообразующая реакция
4) Теперь находим ЭДС у катода и анода по такой формуле:
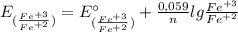
E(Fe⁺³/Fe⁺²) = -0,77 В + 0,059/1 × lg (0,1 моль/л / 10⁻² моль/л) = -0,77 В + 0,059 × lg (0,1 / 0,01) = -0,77 В + 0,059 × lg 10 = -0,77 В + 0,059 × 1 = -0,77 В + 0,059 = -0,711 В
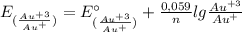
E(Au⁺³/Au⁺) = 1,40 В + 0,059/2 × lg (0,1 моль/л / 10⁻² моль/л) = 1,40 В + 0,0295 × lg (0,1 / 0,01) = 1,40 В + 0,0295 × lg 10 = 1,40 В + 0,0295 × 1 = 1,40 В + 0,0295 = 1,4295 В ≈ 1,43 В
5) Теперь находим ЭДС по полученным значениях :
ε = E(катод) - E(анод) = E(Au⁺³/Au⁺) - E(Fe⁺³/Fe⁺²) = 1,43 В - (-0,711 В) = 1,43 В + 0,711 В = 2,141 В
ответ: ε = 2,141 В
Решено от : 
Реши свою проблему, спроси otvet5GPT
-
Быстро
Мгновенный ответ на твой вопрос -
Точно
Бот обладает знаниями во всех сферах -
Бесплатно
Задай вопрос и получи ответ бесплатно

Популярно: Химия
-
Значения 10%раствор hno3, p=1,054....
 Alex22834529012.03.2022 20:20
Alex22834529012.03.2022 20:20 -
Расставьте коэффициенты в схемах. укажите тип реакции. а) fe2o3 + al...
 PolinaSenatorowa09.07.2020 10:43
PolinaSenatorowa09.07.2020 10:43 -
балов определить степени окисления элементов в веществах: HNO3, Na2SO4...
 snizhanadob13.07.2022 19:16
snizhanadob13.07.2022 19:16 -
С ХИМИЕЙ продолжение)...
 123654825.06.2022 16:47
123654825.06.2022 16:47 -
Определите верные суждения о соединениях углерода...
 WhiteRos31.10.2022 15:58
WhiteRos31.10.2022 15:58 -
4.Процесс восстановления показан схемой:...
 nurik01viper07.12.2020 23:20
nurik01viper07.12.2020 23:20 -
химия 9 клас! напишите результат експеримента...
 Doneore29.02.2020 04:01
Doneore29.02.2020 04:01 -
Кенди ондиру барысында атмосфера ластанады. Атмосферанын ластануына...
 Мария346717.06.2021 19:34
Мария346717.06.2021 19:34 -
1.Расставьте коэффициенты методом электронного баланса в следующих...
 варкатоп14.04.2022 04:13
варкатоп14.04.2022 04:13 -
II Вариант 1. (1 балл) Дайте определение. Реакции ионного обмена –...
 Sofia123456789108.04.2020 14:05
Sofia123456789108.04.2020 14:05

Есть вопросы?
-
Как otvet5GPT работает?
otvet5GPT использует большую языковую модель вместе с базой данных GPT для обеспечения высококачественных образовательных результатов. otvet5GPT действует как доступный академический ресурс вне класса. -
Сколько это стоит?
Проект находиться на стадии тестирования и все услуги бесплатны. -
Могу ли я использовать otvet5GPT в школе?
Конечно! Нейросеть может помочь вам делать конспекты лекций, придумывать идеи в классе и многое другое! -
В чем отличия от ChatGPT?
otvet5GPT черпает академические источники из собственной базы данных и предназначен специально для студентов. otvet5GPT также адаптируется к вашему стилю письма, предоставляя ряд образовательных инструментов, предназначенных для улучшения обучения.
