1.определите, сколько процентов железа от суточной потребности содержится в 100 г печенки, тыквы, фисташек. полученный результат запишите в таблицу. продукт содержание железа, % от суточной потребности печенка тыква фисташки 2. в каком продукте содержится больше всего желе за? 3.вычислите массу фисташек, которые необходимо съедать ежесуточно. для того, чтобы восполнить суточную потребность организма в железе (20 мг)? 4.как правильно принимать железосодержащие препараты? напишите инструкцию по их применению.
Ответы на вопрос:
Объяснение:
1.
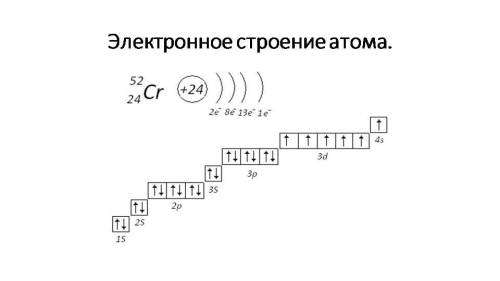
Хром (Cr)
Электронная формула атома: Cr - 1s²2s²2p⁶3s²3p⁶4s¹3d⁵
Электронно графическая формула хрома показана внизу на первом и на втором фотографии↓
2.
а)
серная кислота - H₂SO₄:
В общем виде диссоциацию серной кислоты можно представить в виде:
H₂SO₄⇄ 2H⁺ + SO₄²⁻
1-ая ступень:
H₂SO₄ ⇄ H⁺ + HSO₄⁻
2-ая ступень:
HSO₄⁻ ⇄ H⁺ + SO₄²⁻
Это кислота.
нитрат калия: KNO₃:
В общем виде диссоциацию нитрат калия можно представить в виде: KNO₃ ⇄ K⁺ + NO₃⁻
Это средняя соль (образована сильной щелочью и сильной кислотой).
гидроксид лития: LiOH:
В общем виде диссоциацию гидроксида лития можно представить в виде:
LiOH ⇄ Li⁺ + OH⁻
Это основание.
б)
Na₂SiO₃:
Первая стадия гидролиза :
Na₂SiO₃ + HOH ⇄ NaHSiO₃ + NaOH - молекулярное уравнение
2Na⁺ + SiO₃²⁻ + HOH ⇄ Na⁺ + HSiO₃⁻ + Na⁺ + OH⁻ - полное ионное уравнение
SiO₃²⁻ + HOH ⇄ HSiO₃⁻ + OH⁻ - сокращенное ионное уравнение
Вторая стадия гидролиза :
NaHSiO₃ + H₂O ⇄ H₂SiO₃↓ + NaOH - молекулярное уравнение
Na⁺ + HSiO³⁻ + H₂O ⇄ H₂SiO₃↓ + Na⁺ + OH⁻ - полное ионное уравнение
HSiO₃⁻ + H₂O ⇄ H₂SiO₃↓ + OH⁻ - сокращенное ионное уравнение
Так ка в результате гидролиза образовались гидроксид-ионы (OH⁻), то раствор имеет щелочную среду (pH > 7).
FeS:
Молекулярное уравнение:
FeS + 2H₂O → Fe(OH)₂↓ + H₂S↑
Раствор имеет нейтральную среду.
CuCl₂:
Первая стадия гидролиза :
CuCl₂ + HOH ⇄ CuOHCl + HCl - молекулярное уравнение
Cu²⁺ + 2Cl⁻ + HOH ⇄ CuOH⁺ + Cl⁻ + H⁺ + Cl⁻ - полное ионное уравнение
Cu²⁺ + HOH ⇄ CuOH⁺ + H⁺ - сокращенное ионное уравнение
Вторая стадия гидролиза :
CuOHCl + H₂O ⇄ Cu(OH)₂↓ + HCl - молекулярное уравнение:
CuOH⁺ + Cl⁻ + H₂O ⇄ Cu(OH)₂↓ + H⁺ + Cl⁻ - Полное ионное уравнение:
CuOH⁺ + H₂O ⇄ Cu(OH)₂↓ + H⁺ - сокращенное ионное уравнение
Так как в результате гидролиза образовались ионы водорода (H⁺), то раствор будет иметь кислую среду (pH < 7).
3.
1) С + H₂ → CH₄
2) 2CH₄ + O₂ (t°C, p, кат) → 2CH₃OH
3) CH₃OH + O₂ (t°C, кат) → 2HCOH + H₂O
4) HCHO + Ag₂O (t°) → HCOOH + 2Ag↓
5) HCOOH + C₂H₅OH → HCOOC₂H₅ + H₂O
6) HCOOC₂H₅ + H₂O (NaOH, t°) → C₂H₅OH + HCOOH
Дайте названия веществам (У вас в цепочку все написано то что задали)
4.
пропанол-2: CH₃-CH(CH₃)-OH
пентадиен-1,3: CH₂=CH-CH₂-CH=CH₂
бутановая кислота: CH₃-CH₂-CH₂-COOH
2,4,6 - триметилфенол: C₆H₂(NO₂)₃OH
3-метил-4-этилгексен-1: CH₂=CH-CH(CH₃)-CH(CH₂-CH₃)-CH₂-CH₃
5.
Рассчитайте массу образца сульфата меди (II), если количество вещества составляет 0,6 моль.
Дано:
n(CuSO₄) = 0,6 гр
-------------------------------
Найти:
m(образца CuSO₄) - ?
Мы найдем сначала молекулярную массу сульфата меди (II), а потом мы найдем массу образца сульфата меди (II):
M(CuSO₄) = 64+32+16×4 = 64+32+48 = 160 гр/моль
m(образца CuSO4) = n(CuSO₄)×M(CuSO₄) = 0,6 моль × 160 гр/моль = 96 г р
ответ: m(образца CuSO4) = 96 гр
----------------------------------------------------------------------------------------------
24 мл глицерина растворили в 780 мл воды. Рассчитайте массовую долю данного вещества в растворе.
Дано:
V(HOCH₂-CH(OH)-CH₂OH) = 24 мл
V(H₂O) = 780 мл
------------------------------------------------------------
Найти:
ω(р-р в-ва) -?
1) Сначала найдем массы глицерина и воды, известно что плотность равна 1 гр/мл:
ρ = 1 гр/мл
m(HOCH₂-CH(OH)-CH₂OH) = V(HOCH₂-CH(OH)-CH₂OH)×ρ = 24 мл × 1 гр/мл = 24 гр
m(H₂O) = V(H₂O)×ρ = 780 мл × 1 гр/мл = 780 гр
2) Далее мы находим общую массу раствора:
m(общ. р-ра) = m(HOCH₂-CH(OH)-CH₂OH) + m(H₂O) = 24 гр + 780 гр = 804 гр
3) Далее мы находим массовую долю данного вещества в растворе по такой формуле:
ω(р-р в-ва) = m(вещества)/m(общ. р-ра) × 100%
m(вещества) = m(HOCH₂-CH(OH)-CH₂OH) = 24 гр
ω(р-р в-ва) = 24 гр/804 гр × 100% ≈ 0,03 × 100% ≈ 3%
ответ: ω(р-р в-ва) = 3%

Реши свою проблему, спроси otvet5GPT
-
Быстро
Мгновенный ответ на твой вопрос -
Точно
Бот обладает знаниями во всех сферах -
Бесплатно
Задай вопрос и получи ответ бесплатно

Популярно: Химия
-
2p+5cl2=2pcl5 указать соотношения количества атомов фосфора и хлора, которые...
 робингуд22813.03.2021 00:53
робингуд22813.03.2021 00:53 -
Почему скорость реакций уменьшается с течением времени...
 NCTzen18403.02.2020 05:15
NCTzen18403.02.2020 05:15 -
ЗАДАНИЕ 1. Решите цепочки превращений : А) С2H6-C2H4-C2H5Br Б) С2H4-C2H6-C2H5Br...
 динка8404.10.2022 18:17
динка8404.10.2022 18:17 -
2. Напишите уравнения диссоциации комплексных соединений: В) Na4[NiF6];...
 Katykpoper06.07.2021 02:39
Katykpoper06.07.2021 02:39 -
Із розчину масою 450 г з масовою часткою кухонної солі 24 відсотки випарували...
 nizametdinovaalina02.11.2022 19:50
nizametdinovaalina02.11.2022 19:50 -
2.Определите степень окисления азота в соединении H3N: 1) +1; 2) +3; 3)...
 KarinochkaShiну13.09.2021 03:54
KarinochkaShiну13.09.2021 03:54 -
При взаимодействии 6 литров азота с 12 литров водорода образовался аммиак....
 диман16016.11.2021 19:31
диман16016.11.2021 19:31 -
1.Яку масу естеру можна добути з етанової кислоти масою 48г і етанолу масою...
 kate80710.12.2022 14:31
kate80710.12.2022 14:31 -
Терміновооо! Будь ласка! Вибрати правильну відповідь!!!...
 RinataShayahmurzina22.05.2022 00:01
RinataShayahmurzina22.05.2022 00:01 -
Определите степень окисления атомов по следующим схемам...
 karinkaloseva200316.08.2021 22:46
karinkaloseva200316.08.2021 22:46

Есть вопросы?
-
Как otvet5GPT работает?
otvet5GPT использует большую языковую модель вместе с базой данных GPT для обеспечения высококачественных образовательных результатов. otvet5GPT действует как доступный академический ресурс вне класса. -
Сколько это стоит?
Проект находиться на стадии тестирования и все услуги бесплатны. -
Могу ли я использовать otvet5GPT в школе?
Конечно! Нейросеть может помочь вам делать конспекты лекций, придумывать идеи в классе и многое другое! -
В чем отличия от ChatGPT?
otvet5GPT черпает академические источники из собственной базы данных и предназначен специально для студентов. otvet5GPT также адаптируется к вашему стилю письма, предоставляя ряд образовательных инструментов, предназначенных для улучшения обучения.
