Осуществите превращения: fe3o4→fe→fecl2→fe(oh)2→feo. запишите соответствующие уравнения реакций (уравнение реакций 2 - в молекулярном и в окислительно-восстановительном виде)
Ответы на вопрос:
Объяснение:
Высший оксид вида
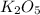
характерен для элементов
V группы а-подгруппы (N, P, As, Sb, Bi)
в таблице Менделеева
Для этих же элементов характерен гидрид вида:
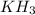
Известно, что в соединении с гидрогеном (водород, Н) массовая доля гидрогена составляет 8.8%.
Напишем уравнение
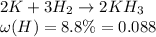
Молекулярная масса КН3 равна:
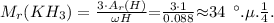
Следовательно, атомная масса элемента К равна:

И действительно в V группе а-подгруппе есть элемент с атомной массой 31 а.е.м.
И этот элемент - фосфор (Р)
Это 15 элемент в Таблице. Его электронная формула имеет вид:
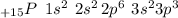
Гидрат оксида фосфора, который соответствует его высшему оксиду (гидроксид фосфора) - это фосфорная кислота, чаще всего имеется в виду ортофосфорная кислота
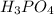
однако может встречаться и метафосфорная кислота
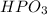
Фосфорная кислота реагирует с
с основными оксидами:
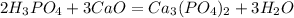
с основаниями:
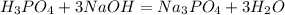
Характерная реакция на фосфат-ионы - взаимодействие с нитратом серебраAgNO3. При этом образуется ярко-желтый осадок фосфата серебра:

Реши свою проблему, спроси otvet5GPT
-
Быстро
Мгновенный ответ на твой вопрос -
Точно
Бот обладает знаниями во всех сферах -
Бесплатно
Задай вопрос и получи ответ бесплатно

Популярно: Химия
-
Из ацетилена и других неорганических реагентов получите этиловый эфир...
 Карамель666609.02.2022 20:45
Карамель666609.02.2022 20:45 -
Вещество немолекулярного строения имеющее высокую температуру кипения...
 Sassha12162806.06.2022 22:24
Sassha12162806.06.2022 22:24 -
Почему атомы хотят снизить свою...
 oliaputliar13.05.2020 16:38
oliaputliar13.05.2020 16:38 -
Укажите при какой реакции , что образуется : вода, газ, осадок и ничего...
 BvbNo917.03.2021 17:19
BvbNo917.03.2021 17:19 -
Суспензией будет взвесь ,ответьте....
 artemkharlamov109.04.2021 03:33
artemkharlamov109.04.2021 03:33 -
Сколько молекул содержится в 10 г so2?...
 ILYA342122.09.2022 20:08
ILYA342122.09.2022 20:08 -
Який тип кристалічних граток у натрії гідроксиді?...
 Motornerplay09.11.2022 12:53
Motornerplay09.11.2022 12:53 -
Определите массу (г) кислоты, которую можно получить путем полного бромирования...
 FUKCтическая27.08.2022 16:21
FUKCтическая27.08.2022 16:21 -
Даны 3 пронумерованные пробирки с растворами а)гидроксида натрия б)хлорида...
 yurijefimow01.10.2021 15:10
yurijefimow01.10.2021 15:10 -
Найдите массу атомов водорода в 594 г воды....
 Zalina4272Bdjdkxc28.03.2023 03:49
Zalina4272Bdjdkxc28.03.2023 03:49

Есть вопросы?
-
Как otvet5GPT работает?
otvet5GPT использует большую языковую модель вместе с базой данных GPT для обеспечения высококачественных образовательных результатов. otvet5GPT действует как доступный академический ресурс вне класса. -
Сколько это стоит?
Проект находиться на стадии тестирования и все услуги бесплатны. -
Могу ли я использовать otvet5GPT в школе?
Конечно! Нейросеть может помочь вам делать конспекты лекций, придумывать идеи в классе и многое другое! -
В чем отличия от ChatGPT?
otvet5GPT черпает академические источники из собственной базы данных и предназначен специально для студентов. otvet5GPT также адаптируется к вашему стилю письма, предоставляя ряд образовательных инструментов, предназначенных для улучшения обучения.
