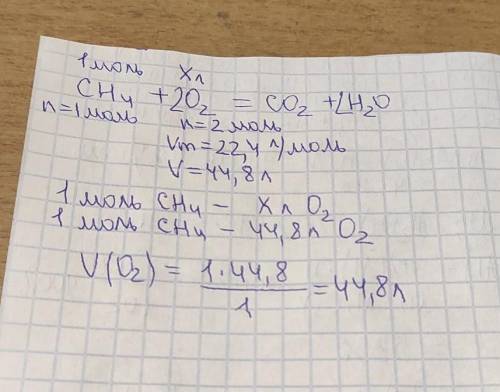Проведении реакции между 100 мл раствора гидроксида натрия и 50 мл соляной кислоты с концентрациями соответственно 1 моль/л и 1,5 моль/л, температура жидкости поднялась на 6,67oс. считая, что плотности растворов равны 1, а их удельная теплоемкость 4,18 дж/г*град, рассчитайте тепловой эффект реакции нейтрализации и напишите уравнение реакции. как изменится тепловой эффект реакции, если соляную кислоту заменить азотной? уксусной? объясните, почему. желательно в подробном
117
212
Ответы на вопрос:
Ур-е реакции: naoh + hcl = nacl + h2o кол-о в-а naoh и hcl равны соответственно (n=cv) 0,1 моль и 0,075 моль. в реакцию вступит по 0,075 моль кислоты и основания. общая m раствора равна 150 г. кол-о выделившейся теплоты находим по формуле q = mcdt = 150*4,18*6,67 = 4182дж. q = q/n = 4182/0,075 = 55760 дж = 55,8 кдж. h+ + oh – = h2o + 55,8 кдж => тепловой эффект реакции не изменится уксусная кислота слабая, процесс ее нейтрализации можно представить состоящим из двух стадий, диссоциации кислоты (а) и взаимодействия ионов водорода (точнее гидроксония) с гидроксид-ионами(б): ch3cooh + oh – = ch3coo – + h2o + q2a) ch3cooh = ch3coo – + h+ - qд ; б) h+ + oh – = h2o + q поскольку первая стадия требует затраты энергии, суммарный тепловой эффект окажется меньше (q2 = q- qд).
Реши свою проблему, спроси otvet5GPT
-
Быстро
Мгновенный ответ на твой вопрос -
Точно
Бот обладает знаниями во всех сферах -
Бесплатно
Задай вопрос и получи ответ бесплатно

Популярно: Химия
-
Составьте схему образования молекулы хлора из атома...
 averdarya25.02.2020 17:43
averdarya25.02.2020 17:43 -
Химия. 9 класс Напишите уравнения диссоциации электролитов: А)...
 kseniya009007.12.2021 15:35
kseniya009007.12.2021 15:35 -
Химия. 9 класс Заполните таблицу: 1. Ионы отличаются от атомов...
 Valdosta1601.04.2021 02:35
Valdosta1601.04.2021 02:35 -
Химия 8класс 17 стр ...
 Lady257520.08.2021 00:26
Lady257520.08.2021 00:26 -
Химия. 9 класс В образце морской воды обнаружены следующие ионы:...
 almosya200519.05.2023 15:18
almosya200519.05.2023 15:18 -
Какая масса магния вступила в реакцию с соляной кислотой если...
 karrtavaya0126.12.2020 15:49
karrtavaya0126.12.2020 15:49 -
Алкан сожгли в избытке кислорода, продукты реакции пропустили...
 romashka189929.09.2020 23:22
romashka189929.09.2020 23:22 -
Спояснениями)составьте формулы оксидов меди, если отношение масс...
 bahahas26.09.2022 04:07
bahahas26.09.2022 04:07 -
Явление а)плавления парафинаб)испарения водыв)горения свечиг)растворение...
 а6пг11.01.2020 19:35
а6пг11.01.2020 19:35 -
Вычислите объем н.у .который займут 128 грамм оксида серы (4).вычислите...
 soficaflymi10.03.2020 11:34
soficaflymi10.03.2020 11:34

Есть вопросы?
-
Как otvet5GPT работает?
otvet5GPT использует большую языковую модель вместе с базой данных GPT для обеспечения высококачественных образовательных результатов. otvet5GPT действует как доступный академический ресурс вне класса. -
Сколько это стоит?
Проект находиться на стадии тестирования и все услуги бесплатны. -
Могу ли я использовать otvet5GPT в школе?
Конечно! Нейросеть может помочь вам делать конспекты лекций, придумывать идеи в классе и многое другое! -
В чем отличия от ChatGPT?
otvet5GPT черпает академические источники из собственной базы данных и предназначен специально для студентов. otvet5GPT также адаптируется к вашему стилю письма, предоставляя ряд образовательных инструментов, предназначенных для улучшения обучения.