Решите рассчитайте ph смеси 50мл 0.1 м бромноватистой кислоты и 50 мл 0.05 м гидроксида натрия.
Ответы на вопрос:
По закону Бойля о газах, молярный объём любого газа равен 22,4 л/моль. Давай найдём кол-во вещества водорода в моль. Для этого поделим объём водорода на молярный объём.
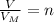
Через n я обозначил количество вещества водорода для этого делим 44,8 л на 22,4. Получим, что количества вещества водорода равно 2 молям. Но так как стехиометрические коэффициенты перед водой и литием в реакции одинаковы мы можем сказать, что количества вещества лития тоже 2 моль.
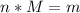
И так, нам требуется найти массу в граммах, но мы можем из таблицы Менделеева найти молярную массу лития (большая эм), она равна 7 грамм на моль. Ну теперь как ты видишь через свою тупую башку мы умножаем количество вещества (2 моль) на молярную массу лития (7 грамм/моль). Получим 14 грамм лития вступило в реакцию с водой.
Реши свою проблему, спроси otvet5GPT
-
Быстро
Мгновенный ответ на твой вопрос -
Точно
Бот обладает знаниями во всех сферах -
Бесплатно
Задай вопрос и получи ответ бесплатно

Популярно: Химия
-
Решить . m глицерина=2,4 кг, который вступает в реакцию с 5,2 кг стеариновой...
 katy310504.05.2022 22:34
katy310504.05.2022 22:34 -
Решить уравнение реакции за схемами p p2o5 h3po4 ca3(po4)2 h3po4 ag3po4...
 anat131.07.2020 08:58
anat131.07.2020 08:58 -
Осуществите превращение, определите тип каждой реакции: ba → bao → ba(oh)2 →...
 seSSS23.03.2021 09:58
seSSS23.03.2021 09:58 -
Напишите формулу вещества 2.3.5-триэтил-2-аминогексановая кислота...
 Snihdsfg28.02.2022 01:45
Snihdsfg28.02.2022 01:45 -
Щелочи.взаимодействие с кислотами,кислотными ,солями, на примере гидроксида...
 nikemaxair5578010.01.2022 22:25
nikemaxair5578010.01.2022 22:25 -
Осуществить превращения: p- p2o5- h3po4- ca3(po4)2- caso4...
 Bandurina06.01.2021 17:31
Bandurina06.01.2021 17:31 -
Определить, какие реакции будут протекать. Написать их уравнения и назвать все...
 Classica2772504.04.2023 17:53
Classica2772504.04.2023 17:53 -
НЕ БУДЬТЕ КАКАШКАМИ!!!! До 75г кухоної солі з масовою часткою солі 0, 25 долили...
 бра431.12.2022 21:33
бра431.12.2022 21:33 -
Объясните, от какого фактора зависит скорость реакции взаимодействия щелочных...
 Nika2006klubnika06.01.2023 14:08
Nika2006klubnika06.01.2023 14:08 -
Рассчитать массу сахара и обьем воды для получения 350 см3 стандартной концентрации....
 Marsel20030124.03.2021 14:11
Marsel20030124.03.2021 14:11

Есть вопросы?
-
Как otvet5GPT работает?
otvet5GPT использует большую языковую модель вместе с базой данных GPT для обеспечения высококачественных образовательных результатов. otvet5GPT действует как доступный академический ресурс вне класса. -
Сколько это стоит?
Проект находиться на стадии тестирования и все услуги бесплатны. -
Могу ли я использовать otvet5GPT в школе?
Конечно! Нейросеть может помочь вам делать конспекты лекций, придумывать идеи в классе и многое другое! -
В чем отличия от ChatGPT?
otvet5GPT черпает академические источники из собственной базы данных и предназначен специально для студентов. otvet5GPT также адаптируется к вашему стилю письма, предоставляя ряд образовательных инструментов, предназначенных для улучшения обучения.
