235,8 г смеси меди(2) и её оксида нагревали в токе водорода,после чего масса твёрдого остатка стала равной 228,6 г.найдите массу полученной при этом воды.
273
284
Ответы на вопрос:
Сводородом реагирует только оксид cuo + h2 = cu + h2o из условия и уравнения реакции делаем вывод что разница между массой исходной смеси и массой остатка - это масса кислорода =235,8-228,6= 7,2г следовательно в состав воды входит 7,2г кислорода молярная масса воды = 2*1 + 1*16 =18 г/моль. 1 моль воды содержит 2г водорода и 16г кислорода. составляем пропорцию 16 : 18 = 7,2 : х отсюда масса воды = 18 * 7,2 / 16 = 8,1г
ответ: 54 г
Дано:
m(Na2O) = 50 г
m(HNO3) = 40 г
Найти: m(NaNO3)-?
50 г 40 г х г
Na2O + 2HNO3 = 2NaNO3 + H2O
62 г 2*63=126г 2*85 = 170г
Найдем количества веществ оксида натрия и азотной кислоты, чтобы понять, какое из веществ в избытке
n(Na2O) = 50/62 = 0,8 моль
n(HNO3) = 40/126 = 0,3 моль
Видим, что оксид натрия в избытке, поэтому расчеты будем проводить по азотной кислоте
=
m(NaNO3) = ≅ 54 г
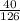
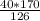
Реши свою проблему, спроси otvet5GPT
-
Быстро
Мгновенный ответ на твой вопрос -
Точно
Бот обладает знаниями во всех сферах -
Бесплатно
Задай вопрос и получи ответ бесплатно

Популярно: Химия
-
Даны формулы MgCO3, KNO3, CaCO3, MgOHCl, SO2 , ZnHCO3, H2SO3....
 Alla95018.08.2021 10:47
Alla95018.08.2021 10:47 -
в поддержании кислотно-щелочного баланса организма и регуляции...
 prokopchukalex08.11.2021 12:13
prokopchukalex08.11.2021 12:13 -
Составьте структурные формулы по описанию, запишите молекулярные...
 Котенок05040202.03.2022 15:43
Котенок05040202.03.2022 15:43 -
врем я горить ! Обчислити pH розчину, якщо концентрація йонів...
 ynifar16.11.2022 04:17
ynifar16.11.2022 04:17 -
Який об єм водню необхідний для перетворення 40 кг три олеїну...
 рома134111.07.2022 02:11
рома134111.07.2022 02:11 -
2)Вычислите объем9л) 20 % гNaOh(плотность=1.1г/см3),требубщийся...
 Liка2509.09.2022 07:15
Liка2509.09.2022 07:15 -
Установите соответствие : химический элемент- организм человека...
 nadezhda98005.03.2023 03:16
nadezhda98005.03.2023 03:16 -
Кто шарит❤️виведіть формулу вуглеводню масова частка карбону в...
 Andrey335509.06.2023 12:54
Andrey335509.06.2023 12:54 -
Решите формулы k2o+h3po4 - na2o+hpo3 - mgo+hno3 - bao+h2s - al2o3+h2so4...
 SureckMozg29.04.2022 05:14
SureckMozg29.04.2022 05:14 -
Ерітінділердің қышқылдық, сілтілік ортасын анықтау е 2. Тұжырымдардың...
 alfa200908.03.2023 18:02
alfa200908.03.2023 18:02

Есть вопросы?
-
Как otvet5GPT работает?
otvet5GPT использует большую языковую модель вместе с базой данных GPT для обеспечения высококачественных образовательных результатов. otvet5GPT действует как доступный академический ресурс вне класса. -
Сколько это стоит?
Проект находиться на стадии тестирования и все услуги бесплатны. -
Могу ли я использовать otvet5GPT в школе?
Конечно! Нейросеть может помочь вам делать конспекты лекций, придумывать идеи в классе и многое другое! -
В чем отличия от ChatGPT?
otvet5GPT черпает академические источники из собственной базы данных и предназначен специально для студентов. otvet5GPT также адаптируется к вашему стилю письма, предоставляя ряд образовательных инструментов, предназначенных для улучшения обучения.
