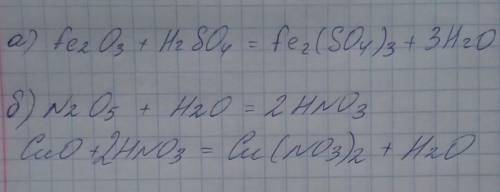80 составьте и решите прямую и обратную на добывание определенного объема вугликислого газа ( складіть і розв'яжіть пряму й обернену і на добування певного об'єму вугликислого газу )
144
434
Ответы на вопрос:
Дано: n(caco3)=m(caco3)/m(caco3)=100 / 100 = 1моль m(caco3)=100 г сaco3 (t°c) = cao + co2 найти: n(co2) = n(caco3) = 1 моль v(co2) - ? v(co2) = n * vм = 1 * 22,4 = 22,4 л дано: n(co2) = v / vм = 22,4 / 22,4 = 1моль v(co2) = 22,4 л caco3 (t°c) = cao +co2 найти: n(caco3) = n(co2) = 1моль m(caco3) - ? m(caco3)=n(caco3) * m(caco3)=1 * 100 = 100г
Сколько литров углекислого газа можно получить из 119 грамм известняка, содержащего 16% примесей?
решение:
находим массовую долю карбоната кальция в известняке: ω(caco3) = 100% − 16% = 84%находим чистую массу карбоната кальция: m(caco3) = 119 г • 84% = 119 г • 0,84 = 100 гпишем уравнение реакции, подставляем сверху данные по условию , снизу данные согласно уравнению: 100 г x лcaco3 = cao + co2↑100 г 22,4 лm(caco3) = 40 + 12 + 16 • 3 = 100 (г/моль)m(caco3) = m • n = 100 г/моль • 1 моль = 100 гv(co2) = 22,4 л/моль • 1 моль = 22,4 лсоставляем пропорцию: 100 г — x л100 г — 22,4 лх = 100 г • 22,4 л / 100 г = 22,4 лответ: 22,4 л
. при взаимодействии 10,8 г кальцинированной соды (безводный карбонат натрия) с избытком раствора соляной кислоты получили 2,24 л (н.у.) оксида углерода (iv). вычислите содержание примеси в соде
решение
2,24/22,4=0,1 моль
0,1*106=10,6 г соды
10,8-10,6/10,8=1,85%
ответ : 1.85%
Реши свою проблему, спроси otvet5GPT
-
Быстро
Мгновенный ответ на твой вопрос -
Точно
Бот обладает знаниями во всех сферах -
Бесплатно
Задай вопрос и получи ответ бесплатно

Популярно: Химия
-
TASK 2 A) Choose the correct word 1 Nurlan was very surprising...
 DashaRossgard26.05.2022 19:44
DashaRossgard26.05.2022 19:44 -
для получения 22.3 гр 2,4,6 тринитро фенола сколько граммов образуют...
 Dasha1254112.02.2020 12:54
Dasha1254112.02.2020 12:54 -
Составить уравнение реакции в малекулярном,полном ионном и сокращённом...
 ivanovartem0202.01.2021 19:08
ivanovartem0202.01.2021 19:08 -
16. напишіть рівняння реакцій, за яких можна здійснити перетворення:...
 ana0stacy18.03.2022 14:52
ana0stacy18.03.2022 14:52 -
1.какой обьем углекислого газа образуется при сгорании 250г угля?...
 Мейси1303.10.2021 06:34
Мейси1303.10.2021 06:34 -
Какой обьем углекислого газа образуется при сгорании 250г угля!...
 mixakov0525.02.2020 06:01
mixakov0525.02.2020 06:01 -
Уравнение реакции в молекулярном и ионном виде при плавании растворов...
 MDMOD128.01.2022 03:12
MDMOD128.01.2022 03:12 -
Изумруд-камень зеленого цвета, формула be3al2(sio3). в изумрудную...
 соня158430.09.2021 00:14
соня158430.09.2021 00:14 -
Сколько грамм 5 %ого раствора серной кислоты надо прибавить к 200ста...
 agibalovaksyu08.10.2021 19:49
agibalovaksyu08.10.2021 19:49 -
Из технического карбида кальция массой 600 кг получили ацетилен...
 talyaarpaci27.11.2022 08:52
talyaarpaci27.11.2022 08:52

Есть вопросы?
-
Как otvet5GPT работает?
otvet5GPT использует большую языковую модель вместе с базой данных GPT для обеспечения высококачественных образовательных результатов. otvet5GPT действует как доступный академический ресурс вне класса. -
Сколько это стоит?
Проект находиться на стадии тестирования и все услуги бесплатны. -
Могу ли я использовать otvet5GPT в школе?
Конечно! Нейросеть может помочь вам делать конспекты лекций, придумывать идеи в классе и многое другое! -
В чем отличия от ChatGPT?
otvet5GPT черпает академические источники из собственной базы данных и предназначен специально для студентов. otvet5GPT также адаптируется к вашему стилю письма, предоставляя ряд образовательных инструментов, предназначенных для улучшения обучения.