Рассчитайте объем раствора с массовой долей гидроксида натрия 12% ( плотность 1,131 г/см3), который необходимо взять для нейтрализации неизвестной насыщенной одноосновной кислоты массой 18,49 г, плотность паров по воздуху которой равна 3,034. запишите структурную формулу кислоты.
279
401
Ответы на вопрос:
Общая формула одноосновных насыщенных кислот - cnh2no2 3,034*29=88 мr кислоты 88-32(о2)=56 cnh2n=14n 14n=56 n=4 значит бутановая к-та 18,49/88=0,21 моль 1моль к- моль naoh 0.=0,21 0,21*40=8,4 гр 8,% % х=70г р-ра 70/1,131=61,89 мл
Объяснение:
1. Урівноважена реакція буде мати наступний вигляд
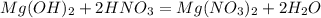
2. Реагентами називають ті речовини, що вступають у хімічну реакцію. Зазвичай це ті речовини, що записані ліворуч знаку рівності. В даному випадку це магній гідроксид та нітратна кислота. Продуктами реакції називають ті речовини, що утворюються у результаті хімічної реакції, та зазвичай записані праворуч знаку рівності. В даному випадку це магній нітрат та вода
3. Перша формула у даній хімічніх реакції це мангій гідроксид
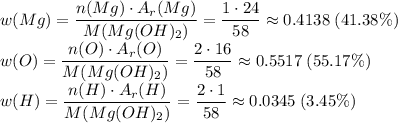
4. З рівняння реакції бачимо, що води утворилося вдвічі більше, ніж було першої речовини, тобто 20 моль. Рахуємо масу води
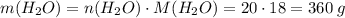
Реши свою проблему, спроси otvet5GPT
-
Быстро
Мгновенный ответ на твой вопрос -
Точно
Бот обладает знаниями во всех сферах -
Бесплатно
Задай вопрос и получи ответ бесплатно

Популярно: Химия
-
Условие задания: Метановая кислота реагирует с: СО2 CuO Сu (OH)2...
 tolodono16.03.2023 00:43
tolodono16.03.2023 00:43 -
Укажіть характеристики, які можна застосувати для опису реакції хлорування...
 gogoja07.01.2021 04:06
gogoja07.01.2021 04:06 -
3 вариант МОЖНО ОТВЕТ ПОЛНОСТЬЮ...
 супермарио326.04.2022 09:00
супермарио326.04.2022 09:00 -
Как решать по приклады с коофицыентами например: n2+h2=nh3...
 romatopovsky03.06.2022 13:42
romatopovsky03.06.2022 13:42 -
Вычислите массу хлорида цинка который образуется при взаимодействии...
 байгинат125.09.2020 17:30
байгинат125.09.2020 17:30 -
! осуществите превращения: hgo→o2→bao→ba(oh)2→h2o→o2→al2o3...
 Xkdidid16.03.2021 06:22
Xkdidid16.03.2021 06:22 -
Нужно решить ионное уравнение, краткую и полную форму: fecl2+naoh=fe(oh)2cтрелка...
 MrLED03.02.2020 01:52
MrLED03.02.2020 01:52 -
Маса залiзнои деталi - 11,2 г. яку кiлькiсть речовини становить така...
 Анечка161103.05.2021 14:55
Анечка161103.05.2021 14:55 -
Составить ф-лы всех возможных солей(ср.,кисл.,осн.) соответствующей...
 888DeLtApLaN88805.04.2021 09:45
888DeLtApLaN88805.04.2021 09:45 -
Яка кількість речовини води міститься у 540 г води...
 мария196531.12.2020 00:00
мария196531.12.2020 00:00

Есть вопросы?
-
Как otvet5GPT работает?
otvet5GPT использует большую языковую модель вместе с базой данных GPT для обеспечения высококачественных образовательных результатов. otvet5GPT действует как доступный академический ресурс вне класса. -
Сколько это стоит?
Проект находиться на стадии тестирования и все услуги бесплатны. -
Могу ли я использовать otvet5GPT в школе?
Конечно! Нейросеть может помочь вам делать конспекты лекций, придумывать идеи в классе и многое другое! -
В чем отличия от ChatGPT?
otvet5GPT черпает академические источники из собственной базы данных и предназначен специально для студентов. otvet5GPT также адаптируется к вашему стилю письма, предоставляя ряд образовательных инструментов, предназначенных для улучшения обучения.
