Закончите уравнения следующих реакций: fe + hci al + h2so4 k + h2o li + h2o fe203 + hno3
261
281
Ответы на вопрос:
Fe+2hcl=fecl2+h2 2al+h2so4=al2(so4)3+h2 2k+2h20= 2koh+h2 2li+2h2o=2lioh+h2 fe203 + 6hno3= 2fe(no3)3 +3 h2o
Найдем количество молей водорода и кислорода в смеси, то есть, сколько моль веществ содержится в 1 моле смеси.
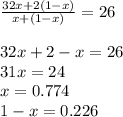
Выходит, что число молей кислорода равно 0.774 на 1 моль в смеси, а число молей водорода равно 0.226 моль на 1 моль смеси. Остается лишь умножить значения на 5, ведь спрашивается про 5 моль смеси.
n(O2)=0.774 * 5 = 3.87 моль
n(H2)=0.226 * 5 = 1.13 моль
При реакции водорода и кислорода образуется вода:
2H2 + O2 => 2H2O
Соотношение водорода и кислорода в реакции 2:1. 2 моля водорода на 1 моль кислорода. Выходит, что кислород в избытке. Считаем по водороду:
n¹(O2) = 0.5n¹(H2) = 0.565 моль
Все 1.13 моль водорода расходуются, вместе. сними уходит 0.565 моль кислорода. Значит, осталось еще:
3.87 моль - 0.565 моль = 3.305 моль кислорода.
Реши свою проблему, спроси otvet5GPT
-
Быстро
Мгновенный ответ на твой вопрос -
Точно
Бот обладает знаниями во всех сферах -
Бесплатно
Задай вопрос и получи ответ бесплатно

Популярно: Химия
-
Чему равен ph раствора натрия гидроксида, в 100 мл которого есть 0,4г...
 Apelsinka3230.10.2022 14:03
Apelsinka3230.10.2022 14:03 -
Рассчитайте относительную плотность по воздуху фтора и фтороводорода...
 кракодиллох112.07.2021 04:27
кракодиллох112.07.2021 04:27 -
(написать соответствующие уравнения) какую пару ионов можно использовать...
 Amdrek01.11.2021 07:31
Amdrek01.11.2021 07:31 -
2. При взаимодействии диоксида углерода с гидроксидом бария образуется...
 ilona12206.11.2022 13:01
ilona12206.11.2022 13:01 -
Вычислите объем углекислого газа, образующегося при горении 25 л (р.с.)...
 astraelenap01fez13.07.2022 09:42
astraelenap01fez13.07.2022 09:42 -
Вода становить основу: атмосфери, гідросфери, літосфери...
 lambert133715.03.2021 00:29
lambert133715.03.2021 00:29 -
5. За до рівнянь яких реакцій можна передати такі перетворення? a) Feci...
 saschaalexandrova11.04.2020 11:10
saschaalexandrova11.04.2020 11:10 -
Каким можно изменить внутреннюю энергию тела? 1) только совершением работы...
 visokolova25.05.2021 23:05
visokolova25.05.2021 23:05 -
Напишите уравнение реакций,при которых можно осуществить следующие превращения:...
 kdhsjs06.01.2022 04:37
kdhsjs06.01.2022 04:37 -
30 г кальция прореагировало с хлороводородной кислотой. найти обьем выделившегося...
 Диана890910.04.2020 08:48
Диана890910.04.2020 08:48

Есть вопросы?
-
Как otvet5GPT работает?
otvet5GPT использует большую языковую модель вместе с базой данных GPT для обеспечения высококачественных образовательных результатов. otvet5GPT действует как доступный академический ресурс вне класса. -
Сколько это стоит?
Проект находиться на стадии тестирования и все услуги бесплатны. -
Могу ли я использовать otvet5GPT в школе?
Конечно! Нейросеть может помочь вам делать конспекты лекций, придумывать идеи в классе и многое другое! -
В чем отличия от ChatGPT?
otvet5GPT черпает академические источники из собственной базы данных и предназначен специально для студентов. otvet5GPT также адаптируется к вашему стилю письма, предоставляя ряд образовательных инструментов, предназначенных для улучшения обучения.
