Ответы на вопрос:
Дано: mр-ра(hcl)=150г w%(hcl)=30% v(na₂co₃)=0.5моль vm=22,4л./моль v( 1. определим массу ссоляной кислоты в 150г ее 30% раствора: m(hci)= ω%=ω%× m(раствора)÷100%=30%×150г. ÷100%=45г.2. определим количество вещества соляной кислоты в ее 45г.: а)находим молярную массу соляной кислотыm(hci )=1+35.5 =36.5г./мольб)находим количество вещества в 45 г. еислотыν(hci)=m(hci)÷m(hci)=45г. ÷36,5г./моль=1,2моль3. запишем уравнение реакции: 2hci+ na₂co₃ = 2naci +co₂ + h₂o 4. анализируем уравнение реакции: по уравнению реакции 2моль соляной кислоты взаимодействует с 1моль карбоната натрия, а в условии 1,2моль соляной кислоты и 0,5моль карбоната натрия. для 2моль hci требуется 1моль na₂co₃ для 1.2мольhci требуется νмоль na₂co₃ ν=1,2мольх1моль÷2моль=0,6моль na₂co₃ делаем вывод, что карбоната натрия недостаток для реакции, дальше решаем используя данные карбоната натрия: 5. по уравнению реакции из 1моль карбоната натрия образуется 1 моль оксида углерода(iv), значит из 0,5 моль карбоната натрия образуется тоже 0,5моль оксида углерода(iv).ν(co₂ )=0,5моль.6. определим объем оксида углерода(iv) количеством вещества 0,5моль: v(co₂)=ν(co₂ )xvm=0,5мольх22,5л./моль=11,2л.7. ответ: образуется газ оксида углерода(iv) объемом 11,2л.
Решение предоставлено на фото
Объяснение:
Коэффициенты поставлены голубым цветом
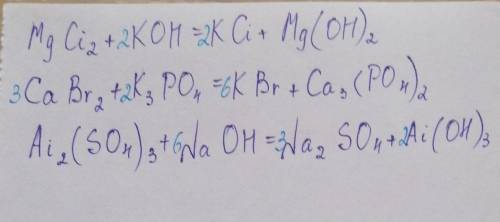
Реши свою проблему, спроси otvet5GPT
-
Быстро
Мгновенный ответ на твой вопрос -
Точно
Бот обладает знаниями во всех сферах -
Бесплатно
Задай вопрос и получи ответ бесплатно

Популярно: Химия
-
1. Для приготовления раствора взято 80мл воды и 10г соли. Определить массовую...
 leramoisejenko26.04.2022 09:11
leramoisejenko26.04.2022 09:11 -
К карбонату кальция массой 200 г добавили раствор, содержащий азотную кислоту...
 79821037407.02.2021 03:39
79821037407.02.2021 03:39 -
Кто зделает дам доп 30 За до часток утворіть форми умовного та наказового...
 Эмиральд24.04.2023 08:08
Эмиральд24.04.2023 08:08 -
Органика Всё во вложении...
 Kov345601.09.2022 08:13
Kov345601.09.2022 08:13 -
3. Яка із перерахованих солей не гідролізує у водних розчинах: а) натрій...
 Max01050714.01.2021 10:29
Max01050714.01.2021 10:29 -
складіть формули гідроксидів елементів та дайте їм назви Cu( ||), Mg, K,...
 Студентка16епта21.05.2021 10:09
Студентка16епта21.05.2021 10:09 -
Під час фотосинтезу вуглекислого газу та води синтезується глюкоза та виділяється...
 masakahdksa04.01.2023 10:07
masakahdksa04.01.2023 10:07 -
Установите соответствие между веществом и продуктами электролиза: 1) KOH...
 Maryyy10019.09.2021 07:18
Maryyy10019.09.2021 07:18 -
3. Назвіть найхарактерніший реактив на Ва2+. Чи відомий такий реактив на...
 dianapodosenova12.11.2020 16:28
dianapodosenova12.11.2020 16:28 -
Вкажіть масову частку води у 100г 2% розчину лимонної кислоти 20% 98% 102%...
 090904424.05.2022 11:07
090904424.05.2022 11:07

Есть вопросы?
-
Как otvet5GPT работает?
otvet5GPT использует большую языковую модель вместе с базой данных GPT для обеспечения высококачественных образовательных результатов. otvet5GPT действует как доступный академический ресурс вне класса. -
Сколько это стоит?
Проект находиться на стадии тестирования и все услуги бесплатны. -
Могу ли я использовать otvet5GPT в школе?
Конечно! Нейросеть может помочь вам делать конспекты лекций, придумывать идеи в классе и многое другое! -
В чем отличия от ChatGPT?
otvet5GPT черпает академические источники из собственной базы данных и предназначен специально для студентов. otvet5GPT также адаптируется к вашему стилю письма, предоставляя ряд образовательных инструментов, предназначенных для улучшения обучения.
