Укого хорошо с уравнениями и , связанные с типами хим.реакций? решить: 1. ca + 2 h2o = ca(oh)2 + h2 , если кальция - 40 г. найти объём газа. 2. mgcl2 = mg + 2 cl , найти массу хлорида магния, образовавшегося в реакции 26 г. магния, содержащего 10% негорючих примесей, с хлором. 3. na2co3 + 2 hcl = 2 nacl + h2co3 , найти массу соли, полученной при взаимодействии 500 г. 20% - го раствора карбоната натрия и соляной кислоты. 4. 2 naoh + cucl2 = 2 nacl + cu(oh)2 , найти массу осадка, полученного при взаимодействии 200 г. гидроксида натрия и хлорида меди.
137
225
Ответы на вопрос:
1. n(ca)=40/40=0,1 (моль) n(h2)=0,19(моль) v(h2)=22,4*0,1=2,24 (л) 2.m чистого(mg)=26*0,9=23,4 n(mg)=23,4/24=0,9 (моль) n(mgcl2)=n(mg)=0,9 m(mgcl2)=0,9*95=85,5 г (не уверен на 100% решена ли 2 правильно) 3.na2co3+2hcl=2nacl+h2o+co2 m(na2co3)=500*0,2=100 (г) n(na2co3)=100/106=0,9(моль) 2n(nacl)=n(na2co3)=0,9 n(nacl)=0,45(моль) m(nacl)=0,45*58,5=26,3 (г) 4.n(naoh)=200/40=5(моль) 2n(cu(oh)2)=n(naoh)=> n(cu(oh)2)=2,5(моль) m(cu(oh)2)=2,5*97=242,5 (г)
Дано:
m(CH₄) = 64 гр
Найти:
n(CH₄) - ?
N(CH₄) - ?
1) Для начала мы найдем количества вещества у метана:
M(CH₄) = 12 + 1×4 = 12 + 4 = 16 гр/моль
n(CH₄) = m(CH₄)/M(CH₄) = 64 гр / 16 гр/моль = 4 моль
2) Теперь находим число молекул содержится в метане:
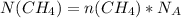 = 4 моль × 6,02×10²³ молекул = 24,08×10²³ молекул
= 4 моль × 6,02×10²³ молекул = 24,08×10²³ молекул
ответ: n(CH₄) = 4 моль N(CH₄) = 24,08×10²³ молекул
Решено от : 
Реши свою проблему, спроси otvet5GPT
-
Быстро
Мгновенный ответ на твой вопрос -
Точно
Бот обладает знаниями во всех сферах -
Бесплатно
Задай вопрос и получи ответ бесплатно

Популярно: Химия
-
Краствору натрий сульфат m-250г с массовой долей соли 15 % доебавили 50 г воды...
 Tanya2110524.08.2021 10:12
Tanya2110524.08.2021 10:12 -
Вычислите сумму коэффициентов в уравнении окисления (полного горения) пропаналя....
 FluffyFoxLove03.04.2020 09:04
FluffyFoxLove03.04.2020 09:04 -
Формула и название высшего гидроксида фосфора и еще что за пункты?...
 Катя4681190931.01.2020 01:22
Катя4681190931.01.2020 01:22 -
Подчеркните формулы органических соединений.из букв,соответствующих правильным...
 AngelinaMois19.09.2021 22:18
AngelinaMois19.09.2021 22:18 -
Сколько граммов гидроксида натрия можно получить из 0,01 моль натрия и 0,2 г....
 mazeke7806.08.2022 02:13
mazeke7806.08.2022 02:13 -
Определите молярную массу эквивалента двухвалентного металла, если 1,5 г его...
 VETALmc00527.04.2020 03:58
VETALmc00527.04.2020 03:58 -
При обработке 2,74 г карбоната и гидрокарбоната натрия избытком соляной кислоты...
 anishenkovayana20.06.2020 03:11
anishenkovayana20.06.2020 03:11 -
При взаимодействии 6,85 г металла с водой выделилось 1,12 л водорода определить...
 help27410.02.2023 17:20
help27410.02.2023 17:20 -
Cao-cac2-c2h2-c6h6-c6h5no2-nh2-c6h5br2nh2...
 justfrog44Arch16.05.2021 17:39
justfrog44Arch16.05.2021 17:39 -
Массовая доля углерода в веществе составляет 51.89%, хлора-38.38%, остальное...
 olya7535720.02.2021 07:10
olya7535720.02.2021 07:10

Есть вопросы?
-
Как otvet5GPT работает?
otvet5GPT использует большую языковую модель вместе с базой данных GPT для обеспечения высококачественных образовательных результатов. otvet5GPT действует как доступный академический ресурс вне класса. -
Сколько это стоит?
Проект находиться на стадии тестирования и все услуги бесплатны. -
Могу ли я использовать otvet5GPT в школе?
Конечно! Нейросеть может помочь вам делать конспекты лекций, придумывать идеи в классе и многое другое! -
В чем отличия от ChatGPT?
otvet5GPT черпает академические источники из собственной базы данных и предназначен специально для студентов. otvet5GPT также адаптируется к вашему стилю письма, предоставляя ряд образовательных инструментов, предназначенных для улучшения обучения.
