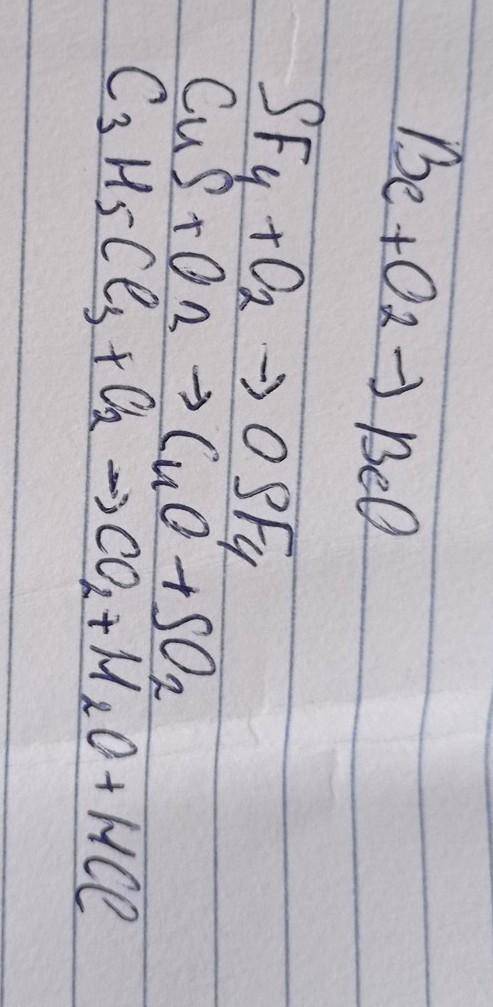При взаимнодействии азота массой 5 г. с водородом,получили 5г. аммиака.вычислите массовую долю выхода аммиака от теоритически возможного?
163
416
Ответы на вопрос:
уравнение данной реакции: nh3 + hcl = nh4cl.рассчитаем количество вещества аммиака, вступившего в реакцию: n(nh3) = v(nh3) / vm = 2,24 л / 22,4 л/моль = 0,1 моль.согласно уравнению реакции, из 1 моль аммиака образуется 1 моль хлорида аммония; значит, из 0,1 моль nh3 должно получиться 0,1 моль nh4cl, что составляет 0,1 моль * (14+4+35,5) г/моль = 5,35 г (так называемая теоретическая масса продукта реакции).в условии сказано, что получено 5 г хлорида аммония (практическая масса). рассчитаем массовую долю выхода продукта в данной реакции: wвых.(nh4cl) = mпракт. * 100 % / mтеор. = 5 г * 100 % / 5,35 г = 93,5 %.
Реши свою проблему, спроси otvet5GPT
-
Быстро
Мгновенный ответ на твой вопрос -
Точно
Бот обладает знаниями во всех сферах -
Бесплатно
Задай вопрос и получи ответ бесплатно

Популярно: Химия
-
Потрібна до в вирішені задачки Обчисліть температуру кипіння та температуру...
 БелинскихАнастасия1102.04.2023 07:24
БелинскихАнастасия1102.04.2023 07:24 -
вещество состава с4н10о2 было получено по реакции с водным раствором...
 Диана1Котова26.11.2020 02:28
Диана1Котова26.11.2020 02:28 -
В ТАБЛИЦЕЙ Какой объём 12,7 %-го раствора серной кислоты (плотность...
 tomchakd14.02.2021 07:44
tomchakd14.02.2021 07:44 -
Продолжить уровнение химической реакции. Cl2+KOH=...
 vkutepova199930.12.2020 09:26
vkutepova199930.12.2020 09:26 -
Напиши уравнения реакции согласно Ахеме Al2O3 эл. Ток, Na3AIF эл....
 Trolololo0913.10.2021 13:02
Trolololo0913.10.2021 13:02 -
Что нужно сделать чтобы получить Н2О...
 Никитаотличник106.04.2020 14:05
Никитаотличник106.04.2020 14:05 -
Реакция бутина-1 с калием...
 Vzinko4212.08.2022 07:19
Vzinko4212.08.2022 07:19 -
Лпз изучение свойств карбоновых кислот на примере уксусной кислоты...
 анжела28607.09.2022 13:43
анжела28607.09.2022 13:43 -
3 Write two new words for each group. 1 one syllable bag, pen, 2 two...
 kryukova2002310.10.2021 00:34
kryukova2002310.10.2021 00:34 -
Решите, , 20 ! пероксид водорода, содержащийся в 340 г 10%-ного раствора,...
 вжух805.05.2022 06:47
вжух805.05.2022 06:47

Есть вопросы?
-
Как otvet5GPT работает?
otvet5GPT использует большую языковую модель вместе с базой данных GPT для обеспечения высококачественных образовательных результатов. otvet5GPT действует как доступный академический ресурс вне класса. -
Сколько это стоит?
Проект находиться на стадии тестирования и все услуги бесплатны. -
Могу ли я использовать otvet5GPT в школе?
Конечно! Нейросеть может помочь вам делать конспекты лекций, придумывать идеи в классе и многое другое! -
В чем отличия от ChatGPT?
otvet5GPT черпает академические источники из собственной базы данных и предназначен специально для студентов. otvet5GPT также адаптируется к вашему стилю письма, предоставляя ряд образовательных инструментов, предназначенных для улучшения обучения.