Ответы на вопрос:
Масса образовавшегося йода 50,8 г.
Объяснение:
Через раствор, содержащий 60 г иодида натрия, пропустили хлор объемом 15,6 л (н.у.). Определите массу образовавшегося йода.
Дано:
m(NaI) = 60 г;
V(Cl₂) = 15,6 л.
Найти: m(I₂).
Решение.
Более сильные галогены вытесняют более слабые из солей. Хлор вытесняет йод из солей.1) Запишем уравнения реакции между иодидом натрия и хлором, в результате которой образуется йод и хлорид натрия.
2NaI + Cl₂ → I₂ + 2NaCl
2) Найдем количество вещества иодида натрия, взятого для реакции.
M(NaCl) = 23 + 127 =150 г/моль.
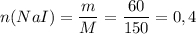 (моль)
(моль)
4) Найдем количество вещества хлора.
По закону Авогадро 1 моль любого газа занимает объем 22,4 л.
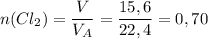 (моль).
(моль).
5) Определим количество выделившегося йода.
По уравнению реакции:
n(NaI) : n(Cl₂) = 2 : 1
У нас даны вещества в отношении
n(NaI) : n(Cl₂) = 0,4 : 0,7 = 2 : 3,5.
Иодид натрия в недостатке, по нему решаем задачу.
По уравнению реакции мольное отношение иодида натрия и йода:
n(NaI) : n(I₂) = 2 : 1 = 0,4 : 0,2.
В результате реакции выделится 0,2 моль йода.
6) Найдем массу выделившегося йода.
M(I₂) = 127 · 2 = 254 г/моль.
m(I₂) = n · M = 0,2 моль · 254 г/моль = 50,8 г.
Масса образовавшегося йода 50,8 г.
#SPJ1
Реши свою проблему, спроси otvet5GPT
-
Быстро
Мгновенный ответ на твой вопрос -
Точно
Бот обладает знаниями во всех сферах -
Бесплатно
Задай вопрос и получи ответ бесплатно

Популярно: Химия
-
Вычислите объём (н.у.) кислорода, необходимый для реакции с 12г...
 лера204216.08.2022 19:54
лера204216.08.2022 19:54 -
Составьте молекулярные и ионные уровнения реакций, с которых можно...
 Оно888585885509.08.2021 20:11
Оно888585885509.08.2021 20:11 -
Имеется 56 л хлора Cl2 при н.у. Определите количество вещества хлора,...
 GarryPotter1511.05.2021 21:25
GarryPotter1511.05.2021 21:25 -
Допишите схемы уравнений-а) mno+o2- mn2o3 б) h2s+o2- s+h2o в) kcio3-...
 Nastya2oo312.04.2022 14:43
Nastya2oo312.04.2022 14:43 -
Обчислити масу 5.6 л (н.у.) сирчастого газу...
 tahmina926.03.2020 17:34
tahmina926.03.2020 17:34 -
Газ,полученный при взаимодействии карбоната кальция и соляной кислоты(реакция...
 shahnozat0226.08.2022 05:08
shahnozat0226.08.2022 05:08 -
Цепочки: 1) s- so2- so3- h2so4- mgso4- mgcl2...
 jybais22817.02.2021 01:18
jybais22817.02.2021 01:18 -
Атомы некоторого элемнта образуют два хлорида с содержанием (по...
 bmorextreme09.02.2020 01:17
bmorextreme09.02.2020 01:17 -
Как соблюдая технику безопасности, разбавить кислоту ?...
 Polinadonut20.05.2021 00:42
Polinadonut20.05.2021 00:42 -
Раствор аммиака плотностью 0,91 г/см3 разбавлен водой в соотношении...
 bogdOJ15.03.2022 04:42
bogdOJ15.03.2022 04:42

Есть вопросы?
-
Как otvet5GPT работает?
otvet5GPT использует большую языковую модель вместе с базой данных GPT для обеспечения высококачественных образовательных результатов. otvet5GPT действует как доступный академический ресурс вне класса. -
Сколько это стоит?
Проект находиться на стадии тестирования и все услуги бесплатны. -
Могу ли я использовать otvet5GPT в школе?
Конечно! Нейросеть может помочь вам делать конспекты лекций, придумывать идеи в классе и многое другое! -
В чем отличия от ChatGPT?
otvet5GPT черпает академические источники из собственной базы данных и предназначен специально для студентов. otvet5GPT также адаптируется к вашему стилю письма, предоставляя ряд образовательных инструментов, предназначенных для улучшения обучения.
