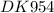Раствор с массовой долей соли 40% имеет плотность 1,2г/мл. рассчитайте,какая масса соли и масса воды необходимы для получения 180 мл раствора определите массу натрия,который вступит в реакцию с 980г 40% раствора фосфорной кислоты. к раствору хлорида железа ( ii ) объемом 352,778 мл (плотность 0.9 г/мл) и массовой долей 20% добавили раствор гидроксида калия объемом 186,667 мл с массовой долей гидроксида калия 25%. определите плотность раствора гидроксида калия
137
225
Ответы на вопрос:
1.
m р-ра=p*v= 1.2г/мл*180мл=216г
m вещ-ва=w*mр-ра=0,4*216г=86,4г
m р-ля(воды)=816-86=129,6г
2.w=40=0.4
m р-ра =980г
m вещ-ва=0.4*980г=392г
m=392 m=x
2h3po4 + 6na = 2na3po4 +3h2
m=v*m= m=v*m=
=163г =138г
m(na)=392*138/162=334
3. fecl2 + 2koh = 2kcl + fe(oh)2
m(fecl2)= p*v=0.2г/мл*352,778мл=70,5556г
w(fecl2)=20%=0.2
m р-ра=70,5556
mвещ-ва=0,2*70,5556=14,1112г
m(koh)=14.1112*112/127=12.445
w(koh)=25%=0.25
mвещ-ва=12,445
mра-ра=12,445/0,25=49,78
p(koh)=m/v= 12,445/49,78=0,25
Реши свою проблему, спроси otvet5GPT
-
Быстро
Мгновенный ответ на твой вопрос -
Точно
Бот обладает знаниями во всех сферах -
Бесплатно
Задай вопрос и получи ответ бесплатно

Популярно: Химия
-
Химическая связь SuSo4...
 xeyal44408.02.2023 19:37
xeyal44408.02.2023 19:37 -
A) Mgce2 4 CON и сделайте ...
 eva7021826.11.2020 13:35
eva7021826.11.2020 13:35 -
1. При раком значение уравнения будут равносильны 3х-5=4 и х +2d=-5...
 eseniadautbekova15.01.2022 18:06
eseniadautbekova15.01.2022 18:06 -
ответ не потеме - жалоба :)...
 sveto4ckaklana07.04.2020 09:09
sveto4ckaklana07.04.2020 09:09 -
Напишіть рівняння реакцій , за до яких можна здійснити перетворення...
 Rinochek1907.08.2021 08:41
Rinochek1907.08.2021 08:41 -
В таблице указаны данные для приготовления растворов с заданной...
 sasha186023.05.2021 04:42
sasha186023.05.2021 04:42 -
Химический состав говна/какашки?...
 Grigoof18.06.2022 10:33
Grigoof18.06.2022 10:33 -
вещество красно-оранжевого цвета, обладает значительной электропроводностью,...
 Анна1460067513.04.2021 09:56
Анна1460067513.04.2021 09:56 -
Какие свойства являются общими для всех оснований для щелочей и...
 Хорошоучусь07.10.2021 09:36
Хорошоучусь07.10.2021 09:36 -
Обчислити масову частку fe у (3 оксиді)...
 aliya77usa20.01.2022 23:18
aliya77usa20.01.2022 23:18

Есть вопросы?
-
Как otvet5GPT работает?
otvet5GPT использует большую языковую модель вместе с базой данных GPT для обеспечения высококачественных образовательных результатов. otvet5GPT действует как доступный академический ресурс вне класса. -
Сколько это стоит?
Проект находиться на стадии тестирования и все услуги бесплатны. -
Могу ли я использовать otvet5GPT в школе?
Конечно! Нейросеть может помочь вам делать конспекты лекций, придумывать идеи в классе и многое другое! -
В чем отличия от ChatGPT?
otvet5GPT черпает академические источники из собственной базы данных и предназначен специально для студентов. otvet5GPT также адаптируется к вашему стилю письма, предоставляя ряд образовательных инструментов, предназначенных для улучшения обучения.