:( 1)до конца протекает реакция в растворе: а)so2 +h2o → б)cuso4 + naoh → в)co2 + h2o → 2)реакцией замещения является : а)fe + cl2 → б)fe + o2→ в)zn +h2so4→ г)mgso4 + koh→ 3)кислую среду имеет раствор соли : а)alcl3 б)kno3 в)na2co3 4)уравнение mno2 + 4hcl → mncl2 + cl2 + 2h2o соответствует реакции: а)гидролиза б)нейтрализации в)окисления-восстановления 5)краткое ионное уравнение h + oh → h2o соответствует реакции: а)naoh + cucl2 → б)hcl + koh → в)bacl2 + h2so4 → г)fecl3 + naoh → 6)равновесие реакций n2 + 3h2 → 2nh3 + q смещается влево при: а)понижении t б)повышении t в)увеличении давления 7)реакцией, которая идёт без изменения степени окисления элементов является : а)naco3 + 2hcl → 2nacl +h2o +co2 б)mg + h2so4 → mgso4 + h2 в)2nano3 → 2nano2+ o2 г)2na + s → na2s 8)масса углерода (г) при тепловом эффекте реакций 33,5 кдж составляет c + o2 → co2 + 402,24 кдж а)4 б)1 в)5
117
155
Ответы на вопрос:
1) б 2) в 3) а 4) в 5) б 6) б 7) а 8) б 12 г -402, 24 кдж х г - 33. 5 кдж х = (12*33.5) /402.24 = 1
Реши свою проблему, спроси otvet5GPT
-
Быстро
Мгновенный ответ на твой вопрос -
Точно
Бот обладает знаниями во всех сферах -
Бесплатно
Задай вопрос и получи ответ бесплатно

Популярно: Химия
-
Составьте формулы оксидов mg, k, s (iv) c (vii) fe (ii) названия...
 РЕЛАД20.12.2020 07:09
РЕЛАД20.12.2020 07:09 -
Какое количество вещества оксида серы(4) соответствует его массе...
 gorbovaekateri08.06.2021 12:05
gorbovaekateri08.06.2021 12:05 -
Определите объем вещества (л): 1,25 моль h2so3 заранее спасиибо...
 jankirik01.05.2020 14:28
jankirik01.05.2020 14:28 -
1. какие вещества, формулы которых ниже, относятся к алкенам: с2н6,...
 fefe22815.03.2022 23:34
fefe22815.03.2022 23:34 -
Расчитайте массу калия который провзаимодействовал с кислородом...
 vasilyeva08079oz7ptx05.12.2020 12:49
vasilyeva08079oz7ptx05.12.2020 12:49 -
Уравнять электронно-ионным методом, указать окислитель и восстановитель.kmno4+k2s+h2o-...
 lilya14kiev30.01.2021 14:02
lilya14kiev30.01.2021 14:02 -
По зоологии 7 класс ответьте на вопросы ! тема: отряд двукрылые...
 id9587477530.06.2022 07:03
id9587477530.06.2022 07:03 -
Найти количество вещества hcio массой 80г...
 DЕNA15.11.2021 14:18
DЕNA15.11.2021 14:18 -
Напишите реакции соляной кислоты и карбоната кальция, с оксидом...
 гуфиn17.01.2020 05:10
гуфиn17.01.2020 05:10 -
При электролизе раствора k2s на аноде выделилось 6,4 г. серы. какой...
 Atalaney30.09.2021 10:35
Atalaney30.09.2021 10:35

Есть вопросы?
-
Как otvet5GPT работает?
otvet5GPT использует большую языковую модель вместе с базой данных GPT для обеспечения высококачественных образовательных результатов. otvet5GPT действует как доступный академический ресурс вне класса. -
Сколько это стоит?
Проект находиться на стадии тестирования и все услуги бесплатны. -
Могу ли я использовать otvet5GPT в школе?
Конечно! Нейросеть может помочь вам делать конспекты лекций, придумывать идеи в классе и многое другое! -
В чем отличия от ChatGPT?
otvet5GPT черпает академические источники из собственной базы данных и предназначен специально для студентов. otvet5GPT также адаптируется к вашему стилю письма, предоставляя ряд образовательных инструментов, предназначенных для улучшения обучения.

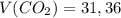 л
л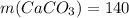 г
г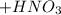
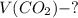
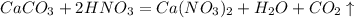
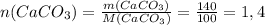 (моль)
(моль)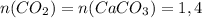 (моль)
(моль)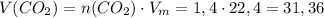 (л)
(л)