Сколько потребуется каменного угля с калорийностью 6300 ккал/кг, что бы получить 20 т негашеной извести из чистого известняка? известно, что на разложение 1 моль известняка требуется 42,5 ккал.
128
313
Ответы на вопрос:
С+ о2 = со2 + 6300 ккал/кг сасо3 = сао + со2 + 42,5 ккал/моль 20 т = 200*10 в 5 степени г n (caco3) = 200*10 в 5 степени/100 г/моль = 2*10 в 5 степени моль q = 2*10⁵ * 42.5/1 = 85*10⁵ ккал m (c) = 85*10⁵/6300 = 1349.2 кг = 1,35 т
17 грам
Объяснение:
Для початку запишемо рівняння реакції:
4Al + 3O₂ = 2Al₂O₃
Знайдемо к-сть речовини О₂:
n = 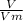 =
= 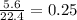 моль
моль
З реакції можна зрозуміти що з 3 моль О₂ ми отримаємо 2 моль оксиду.
Складемо пропорцію:
3 моль = 2 моль
0.25 моль = Х моль
Х моль = 0.25 × 2 / 3 = 0.167 моль
Тепер знайдемо массу оксиду:
m = Mr (Al₂O₃) × n = 0.167 × (27 × 2 + 16 × 3) = 17 грам
Реши свою проблему, спроси otvet5GPT
-
Быстро
Мгновенный ответ на твой вопрос -
Точно
Бот обладает знаниями во всех сферах -
Бесплатно
Задай вопрос и получи ответ бесплатно

Популярно: Химия
-
Вычислите массовую долю NaOH в растворе, полученном при растворении 15 грамм...
 guldanaramazan30.04.2021 02:40
guldanaramazan30.04.2021 02:40 -
Осуществите цепочку химических превращений : SnCl2 = Sn=SnSO4=Sn(NO3) 2=Sn(OH)2...
 Тосямдр03.10.2022 09:53
Тосямдр03.10.2022 09:53 -
В цепочке превращений определите реактивы, необходимые для её осуществления P...
 Поэзия18.11.2020 05:20
Поэзия18.11.2020 05:20 -
Расставьте коэффициенты методом электронного баланса NaNo2+KMnO4+KOH=NaNo3+K2MnO4+H2O?...
 brijet200715.02.2021 02:37
brijet200715.02.2021 02:37 -
Ребят,нужно решить задачу по фотометрическому методу анализа это очень С объяснением...
 siniTamy11.08.2022 11:46
siniTamy11.08.2022 11:46 -
Алкены реагируют с: а) водородом; б) аминокислотами; в) хлором; г) перманганатом...
 nik10291007.11.2021 02:49
nik10291007.11.2021 02:49 -
У 190г води додали 14г натрій хлориду NaCl.Яка масова частка солі у розчині...
 Markiza1126.11.2020 20:54
Markiza1126.11.2020 20:54 -
Решить по (8 класс). : в какой массе золота 583 пробы содержится 5 грамм золота....
 Roman78978907.07.2021 08:31
Roman78978907.07.2021 08:31 -
Расставить степени окисления 2kmno4+5so2+3h2so4=2mnso4+k2so4+5so3+3h2о...
 anmon0701.07.2022 15:54
anmon0701.07.2022 15:54 -
Составить реакцию: бензол- (под действием катализатора c2h5cl) x...
 wtfareudoing01.03.2023 16:23
wtfareudoing01.03.2023 16:23

Есть вопросы?
-
Как otvet5GPT работает?
otvet5GPT использует большую языковую модель вместе с базой данных GPT для обеспечения высококачественных образовательных результатов. otvet5GPT действует как доступный академический ресурс вне класса. -
Сколько это стоит?
Проект находиться на стадии тестирования и все услуги бесплатны. -
Могу ли я использовать otvet5GPT в школе?
Конечно! Нейросеть может помочь вам делать конспекты лекций, придумывать идеи в классе и многое другое! -
В чем отличия от ChatGPT?
otvet5GPT черпает академические источники из собственной базы данных и предназначен специально для студентов. otvet5GPT также адаптируется к вашему стилю письма, предоставляя ряд образовательных инструментов, предназначенных для улучшения обучения.
