Крастворам сульфата натрия, хлорида хрома, хлорида магния, сульфата алюминия и нитрата железа(iii) добавили раствор соды na2co3. в каких случаях будет наблюдаться выделение со2? составьте ионно-молекулярные и молекулярные уравнения соответствующих реакций.
281
485
Ответы на вопрос:
2crcl3+3na2co3+3h2o=2cr(oh)3+ 6nacl+3co2 2cr+2 +6na+ +3co32- +3h2o= 2cr(oh)3 +6na+ +6cl- +3co2 al2(so4)3 +3na2co3+ 3h2o= 2al(oh)3 +3 na2so4 +3co2 2al3+ +3so42- + 6na+ + 3co32- + 3h2o =3al(oh)3 + 6na+ +3so42- +co2 2fe(no3)3 +3na2co3 +3h2o = 2fe(oh)3 +6nano3+ 3co2 2fe3+ +6no3- + 6na+ +3co32- + 3h2o =2fe(oh)3 + 6na+ +6no3- +3co2 na2so4+ na2co3= реакция не идёт mgcl2+ na2co3= mgco3+ 2nacl mg2+ +2cl- + 2na+ +co32- = mgco3 + 2na+ +2cl-
Это уравнение как для ОВР не простое, так как степень окисления железа в 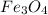 равна
равна 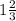 :
:
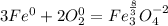
Так что рассмотрим сложный оксид 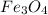 как сумму двух
как сумму двух 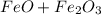
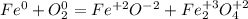
Рассмотрим процессы

Так как количество принятых электронов равно количеству отданных, то перед кислородом идет коэффициент 2, а перед вторым уравнением тоже идет коэффициент 2:
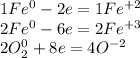
Получается суммарно 3 атома железа отдали 8 электронов и 4 атома кислорода приняли 8 электронов
Кислород - окислитель, железо - восстановитель
Тогда суммарный коэффициент перед железом 1 + 2 = 3, а перед кислородом 2, тогда:

Реши свою проблему, спроси otvet5GPT
-
Быстро
Мгновенный ответ на твой вопрос -
Точно
Бот обладает знаниями во всех сферах -
Бесплатно
Задай вопрос и получи ответ бесплатно

Популярно: Химия
-
Уравнение взаимодействия аммиака с соляной кислотой: nh3(г)+hci(г)=nh4ci(тв)+176,96кдж.рассчитайте...
 DIMjoykin12.07.2020 19:46
DIMjoykin12.07.2020 19:46 -
Найти массу газа которая образует при взаимодействии 212 грамм na2co3...
 Отличница84621.01.2020 05:07
Отличница84621.01.2020 05:07 -
Вычесть массу 0.5 моль сульфата алюминия...
 Shtager150110.01.2021 13:27
Shtager150110.01.2021 13:27 -
Язнаю что сначала надо определить степень окисления, а дальше что?...
 Lucky0ne23.06.2020 05:50
Lucky0ne23.06.2020 05:50 -
Решить цепочку реакций ch4- ch3cl- ch3oh- hcho- hcooh...
 koroleva185821.07.2020 09:20
koroleva185821.07.2020 09:20 -
На смесь массой 20 г,состоящую из магния и меди,подействовали избытком...
 maanna2404.03.2022 02:30
maanna2404.03.2022 02:30 -
Напишите уравнения реакций, иллюстрирующих генетическую связь между...
 Физик576505.03.2020 07:58
Физик576505.03.2020 07:58 -
При растворении карбоната калия в избытке азотной кислоты выделилось...
 VarDim12602.11.2021 04:46
VarDim12602.11.2021 04:46 -
Методом электронного уравняйте равнение окислительно-восстановительной...
 nastyamal010103.02.2022 04:13
nastyamal010103.02.2022 04:13 -
Найти объем углекислого газа, образовавшегося при сгорании 2 литров...
 SimonN125.08.2022 11:01
SimonN125.08.2022 11:01

Есть вопросы?
-
Как otvet5GPT работает?
otvet5GPT использует большую языковую модель вместе с базой данных GPT для обеспечения высококачественных образовательных результатов. otvet5GPT действует как доступный академический ресурс вне класса. -
Сколько это стоит?
Проект находиться на стадии тестирования и все услуги бесплатны. -
Могу ли я использовать otvet5GPT в школе?
Конечно! Нейросеть может помочь вам делать конспекты лекций, придумывать идеи в классе и многое другое! -
В чем отличия от ChatGPT?
otvet5GPT черпает академические источники из собственной базы данных и предназначен специально для студентов. otvet5GPT также адаптируется к вашему стилю письма, предоставляя ряд образовательных инструментов, предназначенных для улучшения обучения.
