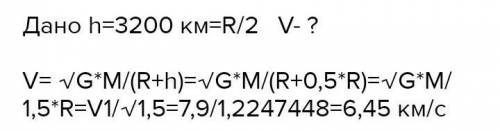Приведите примеры двух металлов, пригодных для протекторной защиты железа. Для обоих случаев напишите уравнение электрохимической
253
366
Ответы на вопрос:
Протекторная защита заключается в присоединении к защищаемому металлическому изделию, металла с более отрицательным значением стандартного электродного потенциала E0, т.е. более активного металла. Для защиты железа подойдут, например, цинк и бериллий:
EFe2+/Fe = — 0,440 В
EZn2+/Zn = — 0,763 В
EBe2+/Be = — 1,850 В
Запишем уравнения электрохимической коррозии во влажной среде, насыщенной кислородом:
Fe—Zn
К: O2 + 2H2O + 4e— = 4OH—
А: Zn — 2e— = Zn2+
2Zn + O2 + 2H2O = 2Zn2++ 4OH—
2Zn + O2 + 2H2O = 2Zn(OH)2
Fe-Be
К: O2 + 2H2O + 4e— = 4OH—
А: Be — 2e— = Be2+
2Be + O2 + 2H2O = 2Be2++ 4OH—
2Be + O2 + 2H2O = 2Be(OH)2
например, цинк и алюминий.
Сущность протекторной защиты заключается в том, что защищаемый метал покрывают более активным металлом. При электрохимической коррозии более активный металл будет разрушаться (анодное окисление), а катод (железо) не будет корродировать до тех пор, пока весь протектор не израсходуется.
В нейтральной влажной среде, насыщенной кислородом, на аноде происходит окисление металла анода, а на катоде - кислородная деполяризация
Для цинка:
Анод (Zn): Zn - 2e- → Zn(2+)
Катод (Fe): 2H2O + O2 + 4e → 4 OH(-)
В растворе будет осаждаться Zn(OH)2, уравнение эл.-хим. коррозии цинка:
2Zn + 2H2O + O2 → 2Zn(OH)2↓
Подобным образом и для алюминия: 4Al + 3O2 + 6H2O → 4Al(OH)3↓
Оксидная пленка, образующаяся на алюминии, обладает высокой плотностью и малой проницаемостью и т.о. защищает металл от воздействия среды.
Сущность протекторной защиты заключается в том, что защищаемый метал покрывают более активным металлом. При электрохимической коррозии более активный металл будет разрушаться (анодное окисление), а катод (железо) не будет корродировать до тех пор, пока весь протектор не израсходуется.
В нейтральной влажной среде, насыщенной кислородом, на аноде происходит окисление металла анода, а на катоде - кислородная деполяризация
Для цинка:
Анод (Zn): Zn - 2e- → Zn(2+)
Катод (Fe): 2H2O + O2 + 4e → 4 OH(-)
В растворе будет осаждаться Zn(OH)2, уравнение эл.-хим. коррозии цинка:
2Zn + 2H2O + O2 → 2Zn(OH)2↓
Подобным образом и для алюминия: 4Al + 3O2 + 6H2O → 4Al(OH)3↓
Оксидная пленка, образующаяся на алюминии, обладает высокой плотностью и малой проницаемостью и т.о. защищает металл от воздействия среды.
Реши свою проблему, спроси otvet5GPT
-
Быстро
Мгновенный ответ на твой вопрос -
Точно
Бот обладает знаниями во всех сферах -
Бесплатно
Задай вопрос и получи ответ бесплатно

Популярно: Другие предметы
-
Главная ошибка при выполнении кувырка вперед?...
 Rus141117.04.2022 23:14
Rus141117.04.2022 23:14 -
ответь я гей а то забаню. Если ответишь получишь...
 artemkafire200520.12.2020 19:42
artemkafire200520.12.2020 19:42 -
Как называются упражнения, содержащие движения руками, ногами, туловищем и головой...
 alinkaaa88825.11.2020 22:02
alinkaaa88825.11.2020 22:02 -
Значение слово Раунд...
 итд418.11.2021 04:21
итд418.11.2021 04:21 -
Чем отличаються векторная графика и inkscape??? ...
 SSS25252530.12.2021 05:41
SSS25252530.12.2021 05:41 -
УМОЛЯЮ 4.Древнегреческий поэт Пиндар писал, что Геракл привез оливу в Олимпию из...
 kcybulina09.02.2023 03:31
kcybulina09.02.2023 03:31 -
Постройте окружность радиусом 5 см. Проведите касательную к этой окружности...
 vladimirnvrskp0845308.09.2022 01:20
vladimirnvrskp0845308.09.2022 01:20 -
ТЕРЕ Сколько основных видов нарушений осанки ты изучил? Е И Land...
 basievtamik11.07.2020 21:10
basievtamik11.07.2020 21:10 -
В каком гаду была 1 миравая вайна...
 dpoarkov5623.10.2020 11:28
dpoarkov5623.10.2020 11:28 -
Скиньте ссылки дешёвой мебели (кровати). Может кто-то знает. ...
 артем115120.09.2020 04:12
артем115120.09.2020 04:12

Есть вопросы?
-
Как otvet5GPT работает?
otvet5GPT использует большую языковую модель вместе с базой данных GPT для обеспечения высококачественных образовательных результатов. otvet5GPT действует как доступный академический ресурс вне класса. -
Сколько это стоит?
Проект находиться на стадии тестирования и все услуги бесплатны. -
Могу ли я использовать otvet5GPT в школе?
Конечно! Нейросеть может помочь вам делать конспекты лекций, придумывать идеи в классе и многое другое! -
В чем отличия от ChatGPT?
otvet5GPT черпает академические источники из собственной базы данных и предназначен специально для студентов. otvet5GPT также адаптируется к вашему стилю письма, предоставляя ряд образовательных инструментов, предназначенных для улучшения обучения.