Определить объем газа, выделившийся при обжиге 312,5г известняка, содержащего 20% примесей.
216
482
Ответы на вопрос:
Дано: Решение:
m(известн.)= 1. определить m(прим.)
= m(CaCO3,пр) =312,5г Ѡ(прим.)=m(прим.):m(CaCO3,пр)=
Ѡ(прим.)=20% = 0,2 m(прим.)=m(CaCO3,пр)* Ѡ(прим.)
V(газа)=V(CO2) = ? m(прим.)=312,5г*0,2=62,5г
m(CaCO3) =m(CaCO3,пр)-m(прим.)=312,5г-62,5г=250г
n (CaCO3)= m(CaCO3):M(CaCO3)
M(CaCO3)= 40+12+16*3=100г/моль
n (CaCO3)= 250г:100г/моль=2,5 моль
V(CO2) по уравнению
CaCO3 → CaO+CO2
1 моль 1 моль
по условию: 2,5 моль х
n(CO2)=2,5 моль V(CO2)= n(CO2)* Vm, Vm=22,4л/моль
V(CO2)=2,5 моль*22,4 л/моль=56л
Ответ:V(CO2)=56л
m(известн.)= 1. определить m(прим.)
= m(CaCO3,пр) =312,5г Ѡ(прим.)=m(прим.):m(CaCO3,пр)=
Ѡ(прим.)=20% = 0,2 m(прим.)=m(CaCO3,пр)* Ѡ(прим.)
V(газа)=V(CO2) = ? m(прим.)=312,5г*0,2=62,5г
m(CaCO3) =m(CaCO3,пр)-m(прим.)=312,5г-62,5г=250г
n (CaCO3)= m(CaCO3):M(CaCO3)
M(CaCO3)= 40+12+16*3=100г/моль
n (CaCO3)= 250г:100г/моль=2,5 моль
V(CO2) по уравнению
CaCO3 → CaO+CO2
1 моль 1 моль
по условию: 2,5 моль х
n(CO2)=2,5 моль V(CO2)= n(CO2)* Vm, Vm=22,4л/моль
V(CO2)=2,5 моль*22,4 л/моль=56л
Ответ:V(CO2)=56л
ответ:Не существует
Объяснение:
Найдем при каких значения параметра уравнение имеет корни
![D/4=(m-6)^2-m=m^2-13m+36=(m-9)(m-4) \geqslant 0 \Leftrightarrow m \in \left( -\infty; 4\right] \cup \left[9; +\infty\right)\\](/tpl/images/3782/4256/c9881.png)
По теореме Виета:
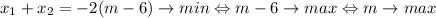
Вывод: сумма корней будет наименьшей при наибольшем значении m, но такого m не существует
Реши свою проблему, спроси otvet5GPT
-
Быстро
Мгновенный ответ на твой вопрос -
Точно
Бот обладает знаниями во всех сферах -
Бесплатно
Задай вопрос и получи ответ бесплатно

Популярно: Другие предметы
-
Задание 1. Выполните задание по образцу. Изобразите графически: G(V,E)...
 cucheryavy14.09.2020 19:02
cucheryavy14.09.2020 19:02 -
нужно написать цель, гипотезу, актуальность проекта и метод. Тема проекта:...
 aliolga20.01.2020 02:21
aliolga20.01.2020 02:21 -
Осанкой принято называть … а) качество позвоночника, обеспечивающее хорошее...
 entogenes01.04.2022 06:38
entogenes01.04.2022 06:38 -
номер 7,8 вообще не понимаю их...
 kimiKatocom02.06.2022 22:53
kimiKatocom02.06.2022 22:53 -
заполнить таблицу! Испанский язык...
 brekisbrekis20.10.2020 22:54
brekisbrekis20.10.2020 22:54 -
ТЕХНОЛОГИЯ ДЛЯ ДЕВОЧЕК Снятие мерки «полуобхват талии» выполняется: А)...
 romasivtsov18.08.2020 19:13
romasivtsov18.08.2020 19:13 -
Расскажите о технике безопасности во время метания ...
 MasterPvP201609.01.2020 10:38
MasterPvP201609.01.2020 10:38 -
Схарактеруйте образ Журдена. Ваше ставлення до героя...
 vika26vf02.04.2022 08:03
vika26vf02.04.2022 08:03 -
Почему матрёшку считает русским сувенирам...
 hojimutito15.06.2022 08:42
hojimutito15.06.2022 08:42 -
Які традиції пов’язані з святом Андрія...
 fac714.05.2023 09:24
fac714.05.2023 09:24

Есть вопросы?
-
Как otvet5GPT работает?
otvet5GPT использует большую языковую модель вместе с базой данных GPT для обеспечения высококачественных образовательных результатов. otvet5GPT действует как доступный академический ресурс вне класса. -
Сколько это стоит?
Проект находиться на стадии тестирования и все услуги бесплатны. -
Могу ли я использовать otvet5GPT в школе?
Конечно! Нейросеть может помочь вам делать конспекты лекций, придумывать идеи в классе и многое другое! -
В чем отличия от ChatGPT?
otvet5GPT черпает академические источники из собственной базы данных и предназначен специально для студентов. otvet5GPT также адаптируется к вашему стилю письма, предоставляя ряд образовательных инструментов, предназначенных для улучшения обучения.
